Metoksymetan ma taki sam wzór cząsteczkowy, taką samą liczbę elektronów i mniej więcej taki sam kształt i rozmiar jak etanol. Pomimo tych podobieństw, wzory strukturalne (organizacja poszczególnych cząsteczek w przestrzeni) są różne między etanolem (CH3CH2OH) i metoksymetanem (CH3OCH3). Ta różnica w konfiguracji atomów w cząsteczkach ma dramatyczny wpływ na lotność etanolu w porównaniu z metoksymetanem.,
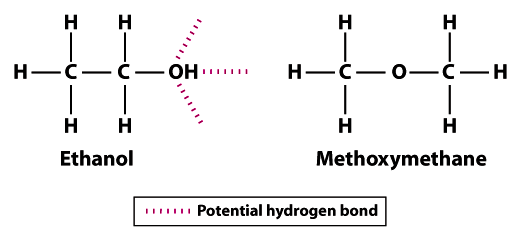 struktury pokazują, dlaczego etanol jest mniej lotny niż metoksymetan; etanol może tworzyć trzy wiązania wodorowe, a metoksymetan nie może tworzyć żadnych.Zauważ, że atomy wodoru w metoksymetanie nie mogą uczestniczyć w wiązaniu wodorowym z sąsiednimi atomami tlenu. Atom wodoru grupy hydroksylowej (OH) w etanolu zwiększa potencjał wiązania wodorowego między sąsiednimi cząsteczkami etanolu. W porównaniu z metoksymetanem etanol nie jest tak Lotny. Temperatura wrzenia 78,5°C dla etanolu jest znacznie wyższa w porównaniu z -24.,8°C dla metoksymetanu. Ten przykład ilustruje znaczenie siły wiązania w ogóle i wiązania wodorowego w szczególności jako wyznacznika zmienności cząsteczki.
struktury pokazują, dlaczego etanol jest mniej lotny niż metoksymetan; etanol może tworzyć trzy wiązania wodorowe, a metoksymetan nie może tworzyć żadnych.Zauważ, że atomy wodoru w metoksymetanie nie mogą uczestniczyć w wiązaniu wodorowym z sąsiednimi atomami tlenu. Atom wodoru grupy hydroksylowej (OH) w etanolu zwiększa potencjał wiązania wodorowego między sąsiednimi cząsteczkami etanolu. W porównaniu z metoksymetanem etanol nie jest tak Lotny. Temperatura wrzenia 78,5°C dla etanolu jest znacznie wyższa w porównaniu z -24.,8°C dla metoksymetanu. Ten przykład ilustruje znaczenie siły wiązania w ogóle i wiązania wodorowego w szczególności jako wyznacznika zmienności cząsteczki.
Dodaj komentarz