wprowadzenie
tylne zastawki cewki moczowej (PUV) są najczęstszą wrodzoną przyczyną dziecięcej niedrożności wylotu pęcherza moczowego (1). Chociaż wskaźnik śmiertelności z PUV znacznie poprawił się wraz z nowoczesnym zarządzaniem medycznym, obturacyjna uropatia nadal pozostaje znaczącym źródłem zachorowalności w dorosłym życiu (2). Do 80% dzieci z PUV wykazuje objawy nietrzymania moczu i infekcji dróg moczowych (3)., Ponadto, do 50% dzieci z PUV rozwinie niewydolność nerek, z obturacyjną uropatią najczęstszą wrodzoną przyczyną przeszczepu nerki (4). Ulotki zastawki obturacyjnej są leczone chirurgicznie wkrótce po urodzeniu; jednak u dzieci z PUV przez całe życie rozwinie się zmienność funkcji pęcherza moczowego. Wykazano, że pogorszenie pęcherza moczowego często występuje po okresie dojrzewania, z rosnącą potrzebą czystego cewnikowania przerywanego (5).
badania z wykorzystaniem różnych modeli zwierzęcych wykazały, że pęcherz jest hormonalnie wrażliwy., W szczególności wykazano, że wymiana testosteronu zwiększa masę mięśni gładkich i stosunek mięśni gładkich do kolagenu u szczurów poddanych orchiektomii (6). Badano model częściowej niedrożności wylotu pęcherza moczowego u samców myszy i wykazano, że powoduje on przerost mięśnia wypieracza pęcherza moczowego (7). Wykazano, że testosteron zwiększa zwłóknienie wypieracza w odpowiedzi na uszkodzenie niedokrwienno-reperfuzyjne u wykastrowanych królików (8). Jednak do tej pory wpływ manipulacji hormonalnych na odpowiedź męskiego pęcherza myszy na uraz spowodowany niedrożnością nie został jeszcze zbadany., Dlatego Zakładamy, że testosteron uczestniczy w niedorozwojowych zmianach włóknistych, które występują po niedrożności wylotu pęcherza moczowego.
materiały i metody
Model częściowej niedrożności pęcherza moczowego myszy
wszystkie procedury chirurgiczne zostały zatwierdzone przez Komitet Opieki nad zwierzętami i użytkowania Instytutu Badań dzieci Stanley Manne. 8-do 10-tygodniowe samce myszy CD1 (Charles River Labs, Chicago, IL, USA) trzymano w oddzielnych klatkach, aby uniknąć zmian poziomu testosteronu spowodowanych przez obudowę grupową. Myszy znieczulono 3% izofluranem i ustawiono na plecach., Podbrzusze ogolono i przygotowano roztworem prowidonu-jodu. Po zapewnieniu zadowalającej indukcji znieczulenia, wykonano nacięcie skóry dolnej części brzucha i przeprowadzono w dół przez ścianę brzucha. Niedrożność wylotu pęcherza przeprowadzono w sposób podobny do poprzedniego raportu, ale z pewnymi różnicami (niedrożność częściowa lub grupa PO) (7). Należy pamiętać, że częściowa niedrożność jest zwykle określana jako „pBOO”, jednak będziemy odnosić się do grupy operacyjnej i eksperymentalnej jako PO., Z przyczepnością do góry na pęcherzu, tępe rozwarstwienie wokół szyi pęcherza (proksymalnie do prostaty u samców myszy) przeprowadzono podczas sporadycznego cofania pęcherza ogonowego, aby zapewnić rozwarstwienie przed moczowodami. Następnie szew polipropylenowy 7-0 przepuszczano wokół szyi pęcherza moczowego i wiązano przez igłę o rozmiarze 23 g umieszczoną obok cewki moczowej. Następnie igłę usunięto., Jeśli samce miały zostać wykastrowane (kastracja częściowa niedrożność lub CPO), jednocześnie jądra wyprowadzano z nacięć brzusznych, sznury nasienne podwiązywano 6-0 szwami polipropylenowymi i Ostro dzielono. Następnie ściankę brzucha i skórę zamykano oddzielnie szwami 5-0 poliglaktyny w sposób przerywany. Zwierzęta pozorowane przeszły identyczną procedurę aż do momentu mobilizacji pęcherza moczowego. Zwierzęta mogły wyzdrowieć, pod warunkiem, Karprofen rozpuszczony w wodzie pitnej, i poświęcić w 1 lub 4 tygodnie po badaniach funkcjonalnych opisanych poniżej., Po uśmierceniu przez zwichnięcie odcinka szyjnego kręgosłupa w znieczuleniu izofluranowym ważono zwierzęta i wycięto pęcherze na poziomie więzadła. Każdy pęcherz był opróżniany z moczu, a następnie osobno ważony dla 12 myszy pozorowanych, 17 PO, 11 CPO i 11 cpot.
podawanie testosteronu
Cypionian Testosteronu podawano kastratowi, częściowo zablokowanej grupie w czasie kastracji i cotygodniowo pooperacyjnie w dawce 10 mg / kg (kastrat częściowej niedrożności testosteronu lub grupy CPOT)., W przypadku myszy, którym podawano zamiennik testosteronu, krew pobierano w czasie poświęcenia i wysyłano do komercyjnego testu testosteronu, aby upewnić się, że otrzymują one odpowiednią zamiennik (Antech Diagnostics, Irvine, CA, USA).
Usuwanie plam na papierze (VSOP)
VSOP wykonywano rano 1, 7 i 28 dni pooperacyjnych dla każdej myszy. Myszy były trzymane w klatkach metabolicznych z podłożem Whatman filter paper przez 2 godziny i miały nieograniczony dostęp do jedzenia i wody. Zobrazowano arkusze papieru filtracyjnego., Zanotowano liczbę i wzór ubytków oraz mierzono powierzchnię każdej plamy ubytkowej za pomocą ImageJ (National Institutes of Health, Bethesda, MD, USA). Stosując standardową krzywą utworzoną z pustych plam ze znanych objętości moczu, obszar plam został przekształcony w Objętość pustą. Analizowano maksymalną objętość voided.
analiza histologiczna
pęcherze były utrwalane w 10% (w / v) formalinie (Sigma) przez 24 h, osadzane w parafinie i cięte poprzecznie z szyjką pęcherza skierowaną w dół w celu uzyskania sekcji 4 µm. Odcinki z 4 sham, 4 PO, 4 CPO i 4 CPO zostały poplamione trichromem Massona., Sekcje były obrazowane w powiększeniach 10 × i 40× za pomocą mikroskopu Leica upright podłączonego do kamery, a obrazy były zapisywane cyfrowo za pomocą OpenLAB for Mac. Współczynnik Col / SM został obliczony za pomocą programu Adobe Photoshop zgodnie z wcześniej opisanym i uśredniony z czterech sekcji 40× na pęcherz. W przypadku immunostarzenia pęcherze utrwalano w 4% (w/v) Formaldehydu wytworzonego z paraformaldehydu (EM) przez noc. Tkankę przemyto w DPB, a następnie równoważono kolejno w 20% (M/v) i 30% (M/v) sacharozy (Sigma) w DPB., Tkanki zostały zamrożone w odseparowanych formach zawierających OCT (Tissue Tech) w kąpieli z izopentanem suchego lodu (Sigma).
przeciwciała Immunofluorescencyjne
zastosowano stałe pęcherze od 3 myszy pozorowanych, 3 PO, 3 CPO i 3 cpot. Sekcje 10 µm od zostały wycięte dla wszystkich eksperymentów. Sekcje przemyto dwukrotnie w PBS, inkubowano przez 5 min w temperaturze pokojowej w PBS + 0,1% Tween (PBT) i blokowano przez 30 min w temperaturze pokojowej z 10% osłem w PBT., Miozyna mięśni gładkich (SMM) została wykryta w ten sam sposób przy użyciu miozyny mięśni gładkich królików (Biomedical Technologies, 1: 100) w połączeniu z przeciwciałem wtórnym przeciwko królikom Alexa Fluor 546 donkey (Life Technologies, 1:400).
Analiza statystyczna
grupy porównano za pomocą ANOVA z analizą post hoc Student–Newman–Keuls. Wyniki z P < 0,05 uznano za znaczące. SPSS v22. 0 został wykorzystany do analizy statystycznej. Paski błędów w cyfrach odzwierciedlają SEM.,
wyniki
PO prowadzi do zmian funkcjonalnych określonych w badaniach urodynamicznych i plam pustych na papierze
częściową niedrożność wylotu pęcherza wykonano na samcach myszy CD-1 i porównano z dwiema grupami: samcami myszy poddawanymi pozorowanym zabiegom chirurgicznym i samcami myszy poddawanymi częściowej niedrożności wylotu pęcherza z kastracją. Mierzyliśmy poziom testosteronu w surowicy u wykastrowanych myszy i stwierdziliśmy, że poziom spadł do (<20 pg/dL) w ciągu 24 godzin po orchiektomii., Wpływ niedrożności na czynność pęcherza określono na podstawie badań urodynamicznych w tych trzech grupach. Rysunek 1A pokazuje podwyższone maksymalne ciśnienie pustki po 1 tygodniu po niedrożności u myszy PO i CPO w porównaniu z myszami po pozorowanych zabiegach chirurgicznych. Reprezentatywne oznaczenia urodynamiczne wykazują również niestabilność po 1 tygodniu u myszy PO i CPO (ryc. 1C). Badanie VSOP wykonywane w 1 tygodniu po niedrożności odzwierciedla wpływ niedrożności na myszy PO i CPO, który nie jest obserwowany u myszy po pozorowanych zabiegach chirurgicznych(ryc. 1B, D)., Tak więc, nasz model PO miał znaczący wpływ funkcjonalny na oddawanie moczu zarówno u myszy PO, jak i myszy CPO 1 tydzień po operacji.
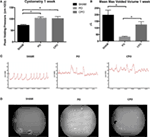
Rysunek 1. Cystometria (a) i średnia maksymalna objętość moczu (B) u Myszy 1 tydzień po podaniu PO. Kolumny to (od lewej do prawej) Sham, PO, CPO. C) reprezentatywne ślady z analizy cystometrii. D) reprezentatywne obrazy pustych plam na papierze Whatman umieszczonym pod myszami przez 2 h, wizualizowane za pomocą obrazowania ultrafioletowego. Paski błędów są SEM., Znaczenie statystyczne (P < 0.05) jest oznaczone gwiazdką.
chociaż niedrożność u myszy CPO wykazano po 1 tygodniu, skutki niedrożności ustąpiły po 4 tygodniach. Badanie VSOP przeprowadzone po 4 tygodniach od niedrożności wykazało, że myszy PO mają trwałe wzory obturacyjne z mniejszą maksymalną ilością pustych objętości niż myszy CPO. W tym samym punkcie czasowym myszy CPO odzyskują maksymalne ilości zużytych, podobne do myszy pozorowanych operacji chirurgicznych (rysunki 3A–C)., Ogólny wzór na VSOP myszy CPO powrócił do normy, podczas gdy myszy PO nadal wykazują niedyskretne rozpylanie moczu wskazujące na utratę kontroli nad pęcherzem moczowym.
przebudowa pęcherza moczowego po kastracji
stwierdzono, że wpływ na czynność pęcherza był skorelowany z makroskopowymi zmianami w pęcherzu u myszy PO i CPO. W czasie poświęcenia myszy w 4 tygodnie po PO, pozorowane pęcherze wyglądały normalnie, ale po I CPO pęcherz były rażąco powiększone (rys. 2A,C–E)., Po wycięciu dystalnej części pęcherza moczowego do wiązania szyjki pęcherza moczowego, pęcherza wyrażono i zważono. Tutaj znaleźliśmy zwiększoną masę pęcherza u myszy PO w porównaniu zarówno do operacji pozorowanej, jak i myszy CPO. Myszy CPO nie wykazywały zwiększonej masy ciała w porównaniu z myszami wykonującymi pozorowane operacje chirurgiczne (rycina 2B). Histologiczną ocenę pęcherzy tych myszy przeprowadzono przy użyciu H&e barwienia i porównywano obszar pęcherza, Obwód i grubość., Zarówno myszy CPO, jak i po wykazały większy obszar i obwód w porównaniu z myszami wykonującymi pozorowane operacje chirurgiczne, odzwierciedlając zmiany związane ze zwiększonym ciśnieniem pęcherza moczowego po PO (ryc. 2F,H). Jednak zwiększoną grubość pęcherza obserwowano tylko u myszy PO (rycina 2G). Korelowało to z niższą masą pęcherza u myszy CPO, co sugeruje, że wzrost wielkości pęcherza wynika głównie z „rozciągania” mięśni pęcherza w przeciwieństwie do prawdziwego przerostu lub rozrostu mięśni pęcherza.
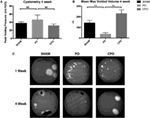
Rysunek 3., Cystometria (A) i średnie maksymalne objętości (B) 4 tygodnie po pozorowanym lub PO. C) reprezentatywne obrazy plam pustych od myszy pozorowanych, po lub CPO 1 i 4 tygodnie po zabiegu. Paski błędów są SEM. Istotność statystyczna jest wskazana powyżej słupków z gwiazdkami (**P < 0.01). NS wskazuje, że różnica nie była istotna statystycznie.,
zwłóknienie pęcherza moczowego zwiększa się po częściowej niedrożności wylotu pęcherza
w celu zbadania, czy wzrost masy pęcherza i grubości ścianki pęcherza był spowodowany wyłącznie przerostem / rozrostem mięśni lub czy wystąpił element zwłóknienia, PO i CPO pęcherza myszy wykonano badanie histologiczne po 4 tygodniach po niedrożności. Dokonano tego wykorzystując zarówno barwienie Trichromem Massona, jak i immunofluorescencję specyficzną dla markera włóknienia (ryc. 4)., Zgodnie z oczekiwaniami, u myszy PO, w następstwie niedrożności, stwierdzono zwiększenie współczynnika Col/SM. W przypadku kastracji nie stwierdzono już zwiększonego stosunku Col/SM (ryc. 4B). Chociaż objętość pęcherza luminalnego była zwiększona u myszy CPO, warstwa mięśniowa nie wykazywała przerostu, o czym świadczy posiadanie takiej samej grubości ściany pęcherza jak myszy pozorowane chirurgiczne. Ponadto, ocena swoistych markerów zwłóknienia Vimentin, Col1a1 i FSP-1 metodą immunofluorescencji wykazała zwiększoną ekspresję u myszy PO w porównaniu z myszami pozorowanymi, z odpowiadającym zmniejszeniem ekspresji u myszy CPO., Wydaje się, że kastracja stwarza warunki, w których występuje przebudowa pęcherza bez włóknistego, argumentując potencjalną rolę testosteronu w pośredniczeniu odpowiedzi włóknistej na uszkodzenie pęcherza.
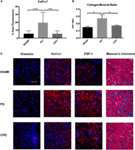
Rysunek 4. Obecność białek włóknistych w ścianie pęcherza moczowego po PO. (A) Wykres Słupkowy pokazujący średnią fluorescencję obszaru procentowego dla Col1a1. Znaczenie jest wskazywane przez * * * p < 0.001 lub ****P < 0.0001. B) wykres słupkowy przedstawiający stosunek Col / SM w pęcherze Sham, PO i CPO., Znaczenie jest wskazywane przez *P < 0.05. C) reprezentatywne obrazy immunofluorescencyjne dla Vimentyny, Col1a1, FSP-1 i Trichromu Massona. Plama przeciwciała jest czerwona, a przeciwstarzeniowa DAPI jest niebieska. Rzędy paneli są sekcjami od (od góry do dołu) Sham, PO i CPO. Wiersze są oznaczone po lewej stronie. Pasek powiększenia w lewym górnym panelu wynosi 100 µm i reprezentuje powiększenie dla wszystkich paneli.,
wprowadzenie egzogennego testosteronu odwraca korzystne efekty kastracji po częściowej niedrożności ujścia pęcherza moczowego
wykazaliśmy, że kastracja w warunkach PO osłabi przebudowę po obstrukcyjną w odniesieniu do przerostu / rozrostu pęcherza moczowego i zwłóknienia. Aby wykazać, że jest to odpowiedź specyficzna dla testosteronu, po kastracji kohorta myszy przeszła suplementację PO i testosteronu. Tutaj użyliśmy testosteronu lub jego zredukowanego produktu dihydrotestosteronu (DHT)., DHT ma 10 razy powinowactwo do receptora androgenowego w porównaniu do testosteronu i nie może być aromatyzowany do estrogenu, zmniejszając prawdopodobieństwo, że zmiany zachodzące w wyniku suplementacji testosteronu są spowodowane zwiększeniem poziomu estrogenu. Maksymalne ilości unieważnione określone przez VSOP były znacząco niższe u myszy CPO plus testosteron (Cpot) lub CPO plus DHT (Cpod) w porównaniu z myszami CPO (rysunek 5A). Zmiany makroskopowe i mikroskopowe obserwowane u myszy PO (ale nie myszy CPO) ponownie pojawiły się w pęcherzach CPOT i cpod., Masa pęcherza moczowego była istotnie większa u myszy CPOT i cpod w porównaniu z myszami CPO (rycina 5B). Pęcherze CPOT i cpod również miały zwiększony współczynnik Col/SM w porównaniu do CPO (rysunek 5D). Markery zwłóknienia były również zwiększone w CPOT i CPOD w porównaniu do pęcherzy CPO, podobnie jak w reakcji na plamę Trichromową Massona(ryc. 5C, E). Wyniki te wykazują, że egzogenna wymiana testosteronu u wykastrowanych samców myszy w pełni przywróciła patologiczne skutki niedrożności pęcherza moczowego., Podsumowując, efekty kastracji i wymiany testosteronu silnie wspierają rolę męskiego androgenu w patogenezie niedrożności pęcherza moczowego.
dyskusja
chłopcy urodzeni z PUV poddają się chirurgicznej resekcji obturacyjnych ulotek wkrótce po porodzie. Jednak pomimo złagodzenia niedrożności wylotu pęcherza u tych dzieci, wielu pacjentów z postępem PUV do pogorszenia pęcherza wymaga czystego przerywanego cewnikowania w celu odpowiedniego opróżnienia pęcherza (3). Zmiany te były często obserwowane po okresie dojrzewania., Zmiany kliniczne u pacjentów z wyciętymi zastawkami były wcześniej przypisywane zmianom fizjologicznym związanym z okresem dojrzewania, takim jak zwiększona filtracja moczu, a nie zmianom hormonalnym (1, 5, 9). Jednak nasze ustalenia sugerują, że androgen może odgrywać ważniejszą rolę niż wcześniej doceniano. Stwierdzamy, że obecność lub brak androgenów specyficznie wpływa na zmiany komórkowe, które występują po niedrożności, w szczególności zwłóknienia.,
informacje z badań, w których testosteron był uzupełniany u pacjentów z chorobami dolnych dróg moczowych mogą dać wgląd w wpływ androgenów na choroby pęcherza moczowego. Dane te są stosunkowo rzadkie, pochodzą głównie z retrospektywnych lub prospektywnych badań obserwacyjnych i badań, w których testosteron podawano mężczyznom z hipogonadem lub eugonadem. Jednak badania te sugerują, że suplementacja testosteronem nie pogarsza LUTS (10, 11)., W szczególności wiele badań wykazało poprawę wyniku IPSS u mężczyzn otrzymujących suplementację androgenami, chociaż wiele z nich nie prowadziło specyficznego badania u mężczyzn ze znaną niedrożnością ujścia pęcherza moczowego,ale raczej obejmowało kohortę leczonych suplementacją testosteronem i mającą różny stopień LUTS na początku. W jednym z badań wykluczono pacjentów ze stwierdzoną niedrożnością szyi pęcherza moczowego. Koritsiadis i in., czy specjalnie porównał objawy i parametry urodynamiczne w badaniach przepływu ciśnienia u mężczyzn hipogonadalnych i eugonadalnych i stwierdził, że poziom testosteronu w surowicy jest ujemnie skorelowany z ciśnieniem wypieracza przy maksymalnym przepływie, ale nie IPSS ani żadnych innych parametrów urodynamicznych (12).
wpływ testosteronu na mięsień wypieracza pęcherza badano również na modelach zwierzęcych. Tek i współpracownicy odkryli, że suplementacja testosteronem chirurgicznie wykastrowanych szczurów powodowała zmniejszenie stosunku kolagenu do mięśni gładkich i zwiększoną pojemność cystometryczną (13). Shortliffe et al., (14) stwierdzono, że wymiana testosteronu u chirurgicznie wykastrowanych szczurów była również związana ze zwiększeniem mięśni gładkich pęcherza moczowego, a także zwiększoną masą pęcherza moczowego (14). Łącznie badania te wskazują, że u niezakłóconych szczurów testosteron stymuluje wzrost mięśni gładkich wypieracza poprzez wciąż niejasny mechanizm. W modelu uszkodzenia pęcherza niedokrwiennego i reperfuzyjnego u samców królików, Chuang et al. wykazano, że kastracja była ochronna przez zmniejszenie zwłóknienia pęcherza moczowego i zmniejszenie ekspresji różnych markerów związanych z zwłóknieniem (8)., Suplementacja testosteronem tych wykastrowanych królików doprowadziła do zwiększonego zwłóknienia wypieracza po urazie pęcherza moczowego. Nasze ustalenia odzwierciedlają te ustalenia i stanowią pierwsze badanie wpływu testosteronu na odpowiedź na uszkodzenie pęcherza moczowego z PO u młodych myszy.
w tym samym czasie niedostatek znalezisk w literaturze zaskoczył nas pierwszymi odkryciami. Jednym z potencjalnych obaw było to, że myszy nie były wystarczająco zablokowane i że nasze odkrycia u wykastrowanych myszy reprezentowały grupę, w której niedrożność po prostu nie wystąpiła., Ostatecznie wiemy, że nie jest to prawdą, ponieważ pęcherze w grupie CPO początkowo miały plamy pustkowe, takie jak grupa z przeszkodą, miały nieprawidłowe ciśnienie przez cystometrię i miały przebudowane pęcherze. W rzeczywistości pęcherze myszy CPO były bardzo różne niż shams, co wskazuje, że operacja PO przyniosła Głębokie efekty. Nasza interpretacja tych wyników jest taka, że w godzinach po operacji ciśnienie wzrasta w obrębie ściany pęcherza i że u normalnych myszy, kolageny i inne matryce usztywniające są konstruowane, aby zapobiec pękaniu pęcherza w jamie brzusznej., Pęcherze myszy CPO miały bardzo małe osadzanie kolagenu w mięśniu wypieracza, ale jednocześnie stały się bardzo duże z cienkimi ścianami. Możliwe jest, że gdy odpowiedź włókniaka jest osłabiona w pęcherzu wysokociśnieniowym, rozciąga się, aby pomieścić gromadzący się mocz. Jest to typowe dla tego, co zaobserwowaliśmy w pęcherzach CPO, ale nie po I CPO. Tak więc, możemy hipotezę, że rola testosteronu może być w szczególności w pośredniczeniu zwłóknienia w ścianie pęcherza moczowego.,
podczas gdy nasza praca specjalnie wykorzystała model pęcherza moczowego do określenia roli testosteronu na zwłóknienie mięśni w odpowiedzi na uszkodzenie mięśni gładkich, wierzymy, że badania te okażą się ważne w wielu procesach chorób włóknistych, które mają związek płciowy. W rzeczywistości zostało to poparte kilkoma badaniami w literaturze. Cho i in. wykazano, że orchiektomia atenuowane włóknienie nerek obserwowane po niedrożności moczowodu. W mysim modelu jednostronnej niedrożności moczowodu nerki samców myszy wykazały zwiększoną ekspresję Alfa-SMA i odkładania się kolagenu (15)., Podobnie jak w przypadku naszego modelu niedrożności pęcherza moczowego, ta odpowiedź włókniakowa została zminimalizowana w przypadku jednoczesnego wykonania orchiektomii z niedrożnością moczowodu. Analogiczne wyniki odnotowano w mysim modelu zwłóknienia serca wtórnego do przeciążenia ciśnieniowego. Tutaj zmiany włókniste w lewej komorze zostały złagodzone przez orchiektomię. Obejmuje to stępienie szlaku sygnałowego tgfß, o którym wiadomo, że jest ważne dla promowania różnicowania miofibroblastów (16). Związane z wiekiem włóknienie serca i nerek zostało również osłabione w wyniku orchiektomii u samców myszy (17)., Ponadto w badaniu przeprowadzonym przez Zhu i współpracowników receptor androgenowy na komórkach mięśni gładkich naczyń był zaangażowany w zwapnienie mięśni gładkich stymulowane testosteronem. Przy użyciu komórek mięśni gładkich naczyń pochodzących z myszy nokautującej specyficzny dla mięśni gładkich receptor androgenowy, zwapnienie zostało stępione w odpowiedzi na leczenie testosteronem w porównaniu do komórek mięśni gładkich typu dzikiego (18). Tak więc coraz większa liczba badań, w tym nasze, znajdują związek między testosteronem a zmianami patologicznymi związanymi ze zwłóknieniem.,
mechanizm stojący za rolą testosteronu w modulowaniu odpowiedzi wypieracza na obrażenia pozostaje niewyjaśniony. Dalsze prace badające dalsze skutki testosteronu w mięśniach wypieracza mogą ujawnić nowe cele terapeutyczne, które można wykorzystać, aby zapobiec lub przynajmniej złagodzić niekorzystną przebudowę tkanki widzianą w ustawieniu PO. Dodatkowo, dawki odpowiedzi badania mogą być prowadzone w celu określenia, jakie stężenia testosteronu w surowicy prowadzić do niekorzystnego remodelingu. Wykazano, że Estrogen łagodzi niedotlenienie tkanek i związane z tym uszkodzenia wypieracza w modelach zwierzęcych., Dalsze badania interakcji między testosteronem i estrogenem w modulowaniu odpowiedzi mięśni wypieracza na uraz mogą również pomóc w dalszym wyjaśnieniu tej ścieżki.
młode samce myszy z częściową niedrożnością ujścia pęcherza moczowego mają mniejsze pęcherze wysokociśnieniowe, które są włókniste. Kastracja wiązała się z większymi objętościami pustymi, mniejszą masą pęcherza i mniejszym zwłóknieniem wypieracza. Zastąpienie testosteronu u wykastrowanych myszy odwróciło te efekty., Wskazuje to, że testosteron odgrywa rolę w modyfikowaniu zmian w mięśniu wypieracza po częściowej niedrożności wylotu pęcherza moczowego u myszy. Dlatego sugerujemy, że podwyższony poziom testosteronu u chłopców z PUV może przyczynić się do zmniejszonej funkcji pęcherza moczowego.
Protokół został zatwierdzony przez Komitet ds. opieki i użytkowania zwierząt.
wkład autora
gromadzenie i analiza danych AF, PF, DB, NK i GS., Af, PF, RD i np. koncepcja, projekt i pisanie manuskryptów.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone w przypadku braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
finansowanie
badania te zostały sfinansowane ze środków Stowarzyszenia Hartwell na np.
4. Holmdahl G, Sillen U. Boys with posterior urethral valves: outcome concerning renal function, bladder function and paternity at ages 31 to 44 years., J Urol (2005) 174(3):1031–4; discussion 1034. doi:10.1097/01.ju.0000170233.87210.4f
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Holmdahl G, Sillen U, Hanson E, Hermansson G, Hjalmas K. Bladder dysfunction in boys with posterior urethral valves before and after puberty. J Urol (1996) 155(2):694–8. doi:10.1097/00005392-199602000-00094
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Gallo CBM, Miranda AF, Felix-Patricio B, Ramos CF, Cardoso LEM, Costa WS, et al. Effects of castration and hormone replacement in the urinary bladder of rats: structural, ultrastructural, and biochemical analysis. J Androl (2012) 33(4):684–90. doi:10.2164/jandrol.111.014159
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Austin JC, Chacko SK, DiSanto M, Canning DA, Zderic SA., Samiec mysi model częściowej niedrożności ujścia pęcherza moczowego ujawnia zmiany w morfologii wypieracza, kurczliwości i ekspresji izoformy miozyny. J Urol(2004) 172 (4 Pt 1): 1524-8. podoba mi się! do obserwowanych nr:101097ju.0000138045.61378.96
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Yassin D-J, El Douaihy Y, Yassin AA, Kashanian J, Shabsigh R, Hammerer PG., Objawy z dolnych dróg moczowych ustępują dzięki terapii zastępczej testosteronem u mężczyzn z hipogonadyzmem o późnym początku: 5-letnie prospektywne, obserwacyjne i podłużne badanie rejestracyjne. World J Urol (2014) 32(4):1049-54. podoba mi się! do obserwowanych nr: 60345-013-1187-z
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cho MH, Jung KJ, Jang HS, Kim JI, Park KM. Orchiektomia łagodzi zwłóknienie nerek po niedrożności moczowodu poprzez zmniejszenie stresu oksydacyjnego u myszy. Am J Nefrol (2012) 35(1):7-16. doi: 10.,1159/000334598
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Montalvo C, Villar AV, Merino D, Garcia R, Ares M, Llano M, et al. Androgens contribute to sex differences in myocardial remodeling under pressure overload by a mechanism involving TGF-beta. PLoS One (2012) 7(4):e35635. doi:10.1371/journal.pone.0035635
CrossRef Full Text | Google Scholar
17., Hewitson TD, Zhao C, Wigg B, Lee SW, Simpson ER, Boon WC, et al. Relaksin i kastracja u samców myszy chronią przed, ale testosteron nasila, związane z wiekiem włóknienie serca i nerek, podczas gdy estrogeny są niezależnym wyznacznikiem wielkości narządów. Endokrynologia (2012) 153(1):188-99. podoba mi się! do obserwowanych nr: 1012102011-1311
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Zhu D, Hadoke PW, Wu J, Vesey AT, Lerman DA, Dweck MR, et al., Ablation of the androgen receptor from vascular smooth muscle cells demonstrates a role for testosterone in vascular calcification. Sci Rep (2016) 6:24807. doi:10.1038/srep24807
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodaj komentarz