niedługo po tym, jak G. N. Lewis spopularyzował model kropki elektronowej, mechanika kwantowa stała się bardzo potężnym modelem, włączając w to zastosowanie do opisu wiązania chemicznego. Dwa modele-model wiązania walencyjnego i model orbitali molekularnych-zostały opracowane niemal równocześnie. Linus Pauling stał się mistrzem modelu Valence ' a Bonda, który jest łatwiejszy do wizualizacji i użycia. Model ten jest zasadniczo mechaniczną wersją modelu elektron-kropka: próbuje opisać, jakie orbitale są używane przez każdy atom, gdy elektrony są wspólne., Na przykład, gdy prosta cząsteczka H2 jest utworzona z atomów wodoru, model wiązania walencyjnego mówi, że orbital s na jednym atomie pokrywa się z orbitalem s na drugim tworząc wiązanie. Jest to czasami przedstawiane przez schemat nakładania się i obraz, jak pokazano na rysunku 30.

rysunek 30. Schemat nakładania się i obraz dla opisu wiązania walencyjnego wodoru dwuatomowego.,
jeden z problemów, które Pauling napotkał na początku swoich pionierskich wysiłków z teorią wiązania valence 'a, jest wyraźnie przykładem prostego obrazu wiązania valence' a w wodzie. Rysunek 31 pokazuje dwa orbitale p na tlen nakładające się z orbitalami s na hydrogeny. Ten obraz pokazuje wyraźnie, że kąt wiązania w wodzie powinien wynosić 90°, ponieważ dwa orbitale p są ustawione wzdłuż osi x i y, a zatem są prostopadłe.

rysunek 31. Pokrywy orbitalne w wodzie.,
w rzeczywistości kąt wiązania w wodzie wynosi 105°, co znacznie odbiega od 90°. Ten rodzaj błędu może nie wydawać się znaczący dla ciebie, ale dla kogoś, kto próbuje sformułować model, który wyjaśni jak najwięcej pewnej części natury, ta różnica między teorią a faktem eksperymentalnym jest bardzo uciążliwa. Pauling dodał kolejną modyfikację do teorii-hybrydyzację., Pauling powiedział, że orbitale atomowe na atomie nie są święte, są tylko jednym z możliwych zestawów równań matematycznych (pamiętajmy o naszym omówieniu modelu falowego), które mogą być użyte do opisu elektronów w tym atomie. Inne zbiory mogą być generowane przez dodawanie i odejmowanie tych orbitali atomowych zgodnie z pewnymi zasadami. Tak więc, jeśli orbital s i trzy orbitale p są połączone matematycznie, powstaje nowy zestaw orbitali, orbitale sp3. Nowy zestaw orbitali ma inną orientacyjną charakterystykę niż zestaw orbitali atomowych., Rysunek 32 pokazuje s i trzy orbitale p w części (a), a następnie w części (b) cztery nowe hybrydy sp3. Jak widać, te hybrydy sp3 są zorientowane w rogach czworościanu. Rysunek 33 pokazuje te hybrydy używane do opisu wiązania w wodzie. Ponieważ kąt między hybrydami wynosi 109°, teraz oczekujemy, że kąt wiązania w wodzie wyniesie 109°. Oczywiście daje nam to lepsze porozumienie z wartością eksperymentalną 105°. (Zauważ, że nie jest to idealne porozumienie, ale to najlepsze, co możemy zrobić.,) Możliwe są również inne kombinacje hybrydyzacji, które podsumowano na rysunku 34.

rysunek 32. hybrydyzacja sp3.
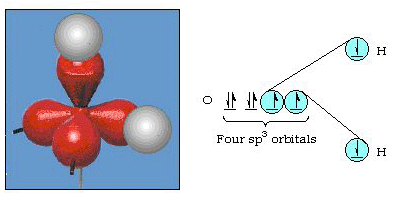
rysunek 33. Zastosowanie hybryd sp3 do wyjaśnienia kąta wiązania w wodzie.
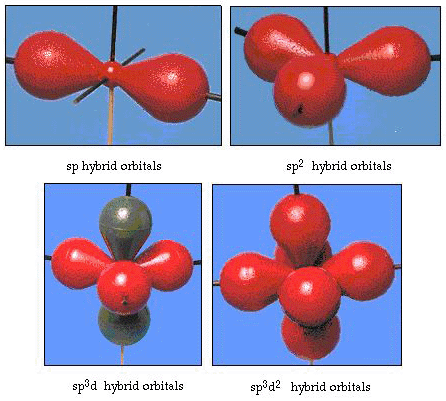
rysunek 34. Inne schematy hybrydyzacji.
press for video
jest jeszcze jedna cecha modelu Valence ' a Bonda, która zasługuje na dyskusję. Jest to ładnie zilustrowane przez naszą znaną cząsteczkę Tlenu, O2., Rysunek 35 pokazuje nakładanie się dwóch orbitali px, co daje nam jedno wiązanie. Jeśli mamy przestrzegać zasady oktetu, musimy również utworzyć kolejną więź. Musi to wynikać z nakładania się dwóch orbitali py lub dwóch Pz (nie ma znaczenia który). Wiązanie to ma swoją gęstość elektronową powyżej i poniżej linii międzywojądrowej, a nie bezpośrednio między dwoma jądrami tlenu. Wiązanie to jest określane jako Wiązanie 1, podczas gdy to, które stawia gęstość elektronów między atomami nazywa się wiązaniem sigma (σ)., Jedną z ciekawych konsekwencji tego obrazu jest to, że oczekuje się, że Wiązanie 1 będzie słabsze niż Wiązanie sigma (nakładanie się orbitali jest słabsze). Oznacza to, że wiązanie podwójne nie ma siły dwóch pojedynczych wiązań, a także jest bardziej podatne na atak przez zewnętrzne atomy, które szukają gęstości elektronowej.

rysunek 35. Tworzenie wiązań sigma i pi w tlenu dwuatomowym.,
jako ostateczny przykład leczenia wiązania walencyjnego, rysunek 36 pokazuje obraz orbitali biorących udział w wiązaniu w etenie, najprostszym nienasyconym węglowodorze (H2C=CH2). Eksperymentalnie wykazano, że kąty wiązania wokół każdego węgla wynoszą prawie 120°. Tak więc, nasz obraz pokazuje wykorzystanie hybryd sp2 (ponieważ mają między sobą kąty 120°) do budowy wiązań sigma. Wiązanie 1 – tworzy się przez nakładanie się dwóch orbitali pz. Ważne jest, aby zauważyć, że Wiązanie 1 wprowadza barierę dla obrotu wokół połączenia węgiel-węgiel., Oznacza to, że jeśli jedna grupa CH2 miałaby się obracać, Wiązanie 1 musiałoby zostać zerwane, co wymagałoby znacznej energii. Konsekwencją tego jest to, że Wiązanie 1 rozwiązuje dwie grupy CH2 w jednej płaszczyźnie, powodując, że ogólna cząsteczka jest płaska.

rysunek 36. Więź w etenie.
model orbitali molekularnych przyjmuje inne podejście. Wykorzystuje wszystkie orbitale na wszystkich atomach do generowania zestawu orbitali, które rozciągają się na wszystkie atomy na całej cząsteczce., Model orbitali molekularnych jest trudniejszy do wizualizacji, ale jest również mocniejszy. Trudny proces określania sposobu łączenia orbitali atomowych w celu wytworzenia orbitali molekularnych jest teraz wykonywany komputerowo nawet dla dużych cząsteczek. Praktykujący chemik wykorzystuje model orbitali molekularnych do przewidywania widm, stanów przejściowych itp., ale w codziennych dyskusjach chemicznych modele wiązań elektronowo – punktowych i walencyjnych nadal rządzą dniem.
Dodaj komentarz