O Grupo Carbonila
C=O é propenso a adições e nucleophillic ataque porque ou carbono da carga positiva e oxigênio a carga negativa. A ressonância da carga positiva parcial do carbono permite que a carga negativa sobre o nucleófilo para atacar o grupo carbonila e tornar-se uma parte da estrutura e uma carga positiva (geralmente um hidrogênio próton) ataca o oxigênio., Apenas um lembrete, o nucleófilo é um bom ácido, portanto, “gosta de prótons” para que ele ataque o lado com uma carga positiva.
Before we consider in detail the reactivity of aldehydes and ketones, we need to look back and remind yourselves of what the bonding picture looks like in a carbonyl. Carbonil carbons são hibridizados sp2, com os três orbitais sp2 formando soverlaps com orbitais sobre o oxigênio e sobre os dois átomos de carbono ou hidrogênio. Estas três ligações adotam geometria trigonal planar., O restante orbital de 2p no carbono carbonila central é perpendicular a este plano, e forma um pbond ‘lado a lado’ com um orbital de 2p no oxigênio.
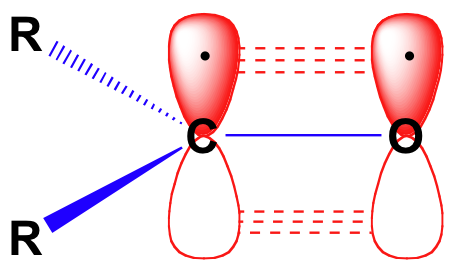
a ligação dupla carbono-oxigénio é polar: o oxigénio é mais electronegativo do que o carbono, pelo que a densidade dos electrões é mais elevada do lado oxigénio da ligação e mais baixa do lado do carbono. Lembre-se que a polaridade de ligação pode ser representada com uma seta dipolar, ou mostrando o oxigênio como segurando uma carga negativa parcial e o carbono carbonila uma carga positiva parcial.,

Uma terceira forma de ilustrar o carbono-oxigênio dipolo é considerar os dois principais contribuintes de ressonância de um grupo carbonila: o formulário principal, que é o que você vê normalmente desenhados em estruturas de Lewis, e um pequeno mas muito importante colaborador em que ambos os elétrons no pbond estão localizadas no oxigênio, dando-lhe um total carga negativa. A última representação mostra o carbono com um orbital de 2p vazio e uma carga positiva total.
Deixe uma resposta