um subnível é um nível de energia definido por quantum theory.In química, sublevels referem-se a energias associadas a electrons.In física, sublevelas também podem referir-se a energias associadas ao núcleo.,
Niels Bohr mais antiga teoria quântica, disse que os elétrons ocupam cascas esféricas centradas no núcleo atômico, tal como dois escudos do elétron mostrado para lítio abaixo:
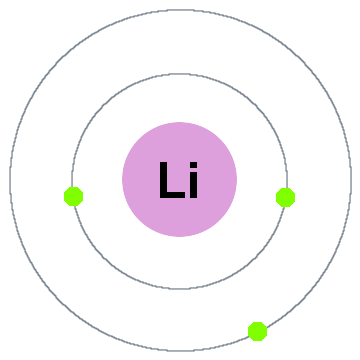
nesta antiga shell modelo movendo-se para fora:
- Shell 1 pode conter até 2 elétrons,
- Shell 2 pode conter até 8 elétrons,
- Shell 3 pode acomodar até 18 elétrons,
- Shell 4 pode conter até 32 elétrons,
- Shell 5 pode conter até 50 elétrons…
cada concha é realmente um nível de energia., Quanto maior a concha, maior a energia do(s) Seu (s) elétron (s). Todos os elétrons que compartilham uma concha são degenerados, o que significa que eles têm a mesma quantidade de energia.os avanços na espectroscopia revelaram que as conchas podem realmente conter sub-conchas/sub-níveis.Os elétrons na concha 3, por exemplo, podem ter diferentes quantidades de energia uns dos outros porque ocupam diferentes sub-níveis.
O diagrama do nível de energia abaixo mostra sub-níveis tão altos quanto o nível de energia dos orbitais 5f.,Os sub-níveis continuam a aumentar as energias, mas o 5f é um local adequado para deixar uma descrição introdutória.
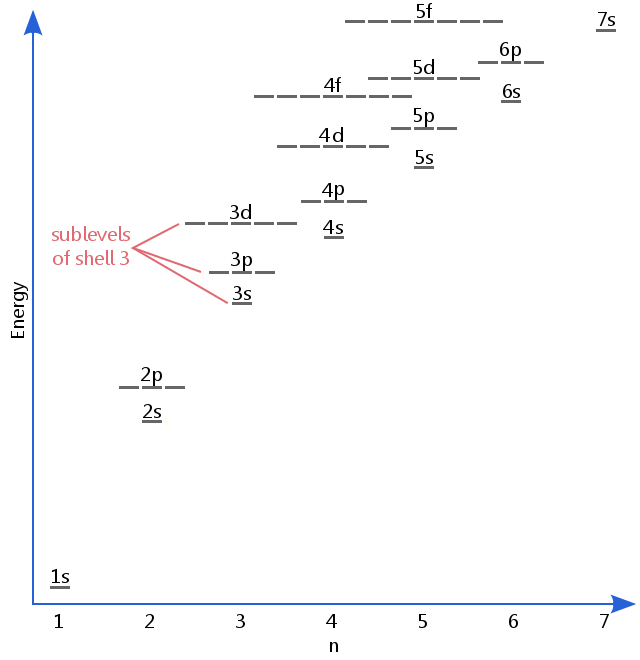

De elétrons subníveis são conhecidos pelas letras s, p, d e f.Assim, por exemplo, elétrons no subnível s do shell de 3 de ter uma quantidade diferente de energia de elétrons no p e d níveis de shell 3.(Este não é o caso do hidrogénio., Todos os sub-níveis de hidrogênio têm a mesma energia, porque o hidrogênio só tem um elétron.)
s, p, d, E F sublevels
o subnível ocupado por qualquer elétron é determinado pelo número quântico angular do elétron, l.,div id=”7de4153d3c”>
The energy level diagram excerpt below shows the sublevels corresponding to different values of l in the fourth electron shell.,
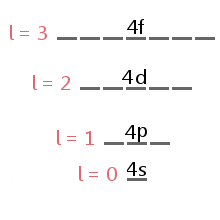
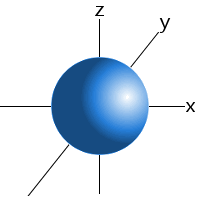
Subnível orbitais têm formas características que podem ser usadas para explicar e prever as ligações químicas que os átomos podem se formar.Estas formas são baseadas na probabilidade de encontrar um elétron em qualquer local em particular orbitando o núcleo.por exemplo, podemos dizer que um elétron no subnível 1s de um átomo de hidrogênio será encontrado 99 por cento do Tempo em algum lugar em uma esfera com um determinado raio em torno do núcleo.Esta é a razão pela qual podemos desenhar os orbitais do subnível s como uma esfera.,orbitais para sub-níveis superiores também são desenhados com base em onde os elétrons de um átomo são mais prováveis de ser encontrados. Veja orbitais para mais detalhes.
Um subnível s do orbital
Subnível Exemplos
Exemplos de subníveis encontrado em vários átomos são mostrados abaixo. O sobrescrito mostra o número de elétrons em cada subnível.
de Hidrogênio: 1s1
de Carbono: 1s2 2s2 2p2
Cloro: 1s2 2s2 2p6 3s2 3p5
Argônio: 1s2 2s2 2p6 3s2 3p6
Em geral, os elétrons vão para a de menor energia disponível subnível., A ordem geral em que os sublevéis são preenchidos é:
1s 2s 2p 3s 3p 4s 3d 4P 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
dado isto, podemos responder a perguntas como: “o que são os sublevéis de elétrons do potássio?”
potássio tem 19 elétrons, e sabemos que os orbitais s possuem um máximo de dois elétrons e p um máximo de seis. Os sublevéis de electrões de potássio serão:
Deixe uma resposta