Fundo
a Insulina é um hormônio que regula a quantidade de glicose (açúcar) no sangue e é necessária para que o corpo funcione normalmente. A insulina é produzida pelas células do pâncreas, denominadas ilhotas de Langerhans. Estas células libertam continuamente uma pequena quantidade de insulina no organismo, mas libertam picos da hormona em resposta a um aumento do nível de glucose no sangue., certas células do organismo alteram os alimentos ingeridos em energia, ou glucose sanguínea, que as células podem utilizar. Sempre que uma pessoa come, a glicemia aumenta. A glucose no sangue elevada desencadeia as células nos ilhéus de Langerhans para libertar a quantidade necessária de insulina. A insulina permite que a glucose sanguínea seja transportada do sangue para as células. As células têm uma parede externa, chamada membrana, que controla o que entra e sai da célula. Os pesquisadores ainda não sabem exatamente como a insulina funciona, mas eles sabem que a insulina se liga aos receptores na membrana celular., Isto ativa um conjunto de moléculas de transporte para que glicose e proteínas possam entrar na célula. As células podem então usar a glicose como energia para realizar suas funções. Uma vez transportado para a célula, o nível de glucose no sangue volta ao normal dentro de horas. sem insulina, a glicemia acumula-se no sangue e as células estão esfomeadas da sua fonte de energia. Alguns dos sintomas que podem ocorrer incluem fadiga, infecções constantes, visão ofegante dos olhos, dormência, formigueiro nas mãos ou pernas, aumento da sede, e cicatrização lenta de hematomas ou cortes., As células vão começar a usar gordura, a fonte de energia armazenada para emergências. Quando isso acontece por muito tempo o corpo produz cetonas, produtos químicos produzidos pelo fígado. As cetonas podem envenenar e matar células se se acumularem no corpo durante um longo período de tempo. Isto pode levar a doenças graves e coma. as pessoas que não produzem a quantidade necessária de insulina têm diabetes. Existem dois tipos gerais de diabetes. O tipo mais grave, conhecido como diabetes tipo I ou diabetes juvenil, é quando o organismo não produz qualquer insulina., Os diabéticos tipo I injectam-se normalmente com diferentes tipos de insulina três a quatro vezes por dia. A dose é tomada com base na leitura da glucose sanguínea da pessoa, tirada de um medidor de glucose. Os diabéticos tipo II produzem alguma insulina, mas não é suficiente ou as suas células não respondem normalmente à insulina. Isso geralmente ocorre em pessoas obesas ou de meia idade e mais velhas. Os diabéticos tipo II não necessitam necessariamente de tomar insulina, mas podem injectar insulina uma ou duas vezes por dia., existem quatro tipos principais de insulina fabricados com base na rapidez com que a insulina começa a trabalhar, quando atinge o pico e quanto tempo dura no organismo. De acordo com a Associação Americana de Diabetes, a insulina de ação rápida atinge o sangue em 15 minutos, picos de 30 a 90 minutos, e pode durar cinco horas. A insulina de acção curta atinge o sangue em 30 minutos, atinge o pico cerca de duas a quatro horas depois e permanece no sangue durante quatro a oito horas., A insulina de Acção intermédia atinge o sangue duas a seis horas após a injecção, atinge picos de quatro a 14 horas mais tarde e pode durar 14 a 20 horas no sangue. E a insulina de acção prolongada leva de seis a 14 horas para começar a trabalhar, tem um pequeno pico pouco depois, e permanece no sangue por 20 a 24 horas. Diabéticos cada um têm diferentes respostas e necessidades de insulina para que não há um único tipo que funciona melhor para todos. Algumas insulinas são vendidas com dois dos tipos misturados num frasco.,
história
Se o organismo não produzir qualquer insulina ou insulina suficiente, as pessoas precisam tomar uma versão fabricada dela. A principal Utilização da produção de insulina é para diabéticos que não produzem o suficiente ou qualquer insulina naturalmente. antes de os investigadores descobrirem como produzir insulina, as pessoas que sofriam de diabetes tipo I não tinham hipótese de ter uma vida saudável. Em 1921, os cientistas canadenses Frederick G. Banting e Charles H. Best purificaram com sucesso a insulina do pâncreas de um cão. Ao longo dos anos, os cientistas fizeram melhorias contínuas na produção de insulina., Em 1936, pesquisadores encontraram uma maneira de fazer insulina com uma libertação mais lenta no sangue. Eles adicionaram uma proteína encontrada no esperma do peixe, protamina, que o corpo se decompõe lentamente. Uma injecção durou 36 horas. Outro avanço veio em 1950, quando os pesquisadores produziram um tipo de insulina que agiu um pouco mais rápido e não permanece na corrente sanguínea por tanto tempo. Na década de 1970, os pesquisadores começaram a tentar produzir uma insulina que imitava mais como a insulina natural do organismo funcionava: liberando uma pequena quantidade de insulina o dia todo com surtos ocorrendo nas refeições., os investigadores continuaram a melhorar a insulina, mas o método de produção de base permaneceu o mesmo durante décadas. A insulina foi extraída do pâncreas de bovinos e suínos e purificada. A estrutura química da insulina nestes animais é apenas ligeiramente diferente da insulina humana, razão pela qual funciona tão bem no corpo humano. (Apesar de algumas pessoas terem um sistema imunitário negativo ou reacções alérgicas.) Then in the early 1980s biotechnology revolutionized insulina synthesis. Os investigadores já tinham descodificado a estrutura química da insulina em meados dos anos 50., Eles logo determinaram a localização exata do gene da insulina no topo do cromossomo 11. Em 1977, uma equipe de pesquisa tinha fundido um gene de insulina de rato em uma bactéria que então produzia insulina.

em 1891, Frederick Banting nasceu em Alliston, Ontário. Graduou-se em 1916 na Universidade de Toronto medical school. Após o serviço de Corpo Médico na Primeira Guerra Mundial, Banting se interessou por diabetes e estudou a doença na Universidade de Ontário Ocidental., em 1919, Moses Barron, um pesquisador da Universidade de Minnesota, mostrou o bloqueio do ducto conectando as duas partes principais do pâncreas causou o encolhimento de um segundo tipo de célula, o acinar. Banting acreditava que ao ligar o ducto pancreático para destruir as células acinares, ele poderia preservar a hormona e extraí-la das células de ilhéu. Banting propôs isso ao chefe do Departamento de Fisiologia da Universidade de Toronto, John Macleod., Macleod rejeitou a proposta de Banting, mas forneceu espaço de laboratório, 10 cães, e um estudante de medicina, Charles Best
começando em maio de 1921, Banting e melhor amarrado de ductos pancreáticos em cães para que as células acinares atrofia, em seguida, removeu o pâncreas para extrair fluido das células de ilhéu. Enquanto isso, eles removeram pancreases de outros cães para causar diabetes, em seguida, injetou o fluido das células de ilhéu. Em janeiro de 1922, Leonard Thompson, de 14 anos, tornou-se o primeiro ser humano a ser tratado com sucesso para a diabetes usando insulina. Best received his medical degree in 1925., Banting insistiu melhor também ser creditado, e quase recusou seu Prêmio Nobel porque Best não foi incluído. Best tornou-se chefe do Departamento de Fisiologia da Universidade de Toronto em 1929 e diretor do Banting da universidade e melhor departamento de pesquisa médica após a morte de Banting em 1941. nos anos 80, os investigadores utilizaram a engenharia genética para fabricar uma insulina humana. Em 1982, a Eli Lilly Corporation produziu uma insulina humana que se tornou o primeiro produto farmacêutico aprovado por engenharia genética., Sem a necessidade de depender de animais, os pesquisadores poderiam produzir insulina geneticamente modificada em suprimentos ilimitados. Também não continha nenhum dos contaminantes animais. A utilização de insulina humana também dissipou quaisquer preocupações quanto à transferência de quaisquer potenciais doenças animais para a insulina. Enquanto as empresas ainda vendem uma pequena quantidade de insulina produzida a partir de animais—principalmente suínos—a partir dos anos 80, os utilizadores de insulina mudaram-se cada vez mais para uma forma de insulina humana criada através de tecnologia de ADN recombinante., De acordo com a Eli Lilly Corporation, em 2001 95% dos usuários de insulina na maioria das partes do mundo tomam alguma forma de insulina humana. Algumas empresas pararam completamente de produzir insulina animal. As empresas estão se concentrando em sintetizar insulina humana e análogos de insulina, uma modificação da molécula de insulina de alguma forma. a insulina humana é cultivada no laboratório dentro de bactérias comuns. Escherichia coli é de longe o tipo de bactéria mais utilizado, mas levedura também é usado. os investigadores precisam da proteína humana que produz insulina., Os fabricantes conseguem isto através de uma máquina de sequenciamento de aminoácidos que sintetiza o ADN. Os fabricantes conhecem a ordem exata dos aminoácidos da insulina (as moléculas à base de nitrogênio que se alinham para formar proteínas). Existem 20 aminoácidos comuns. Os fabricantes introduzem aminoácidos da insulina, e a máquina de sequenciamento liga os aminoácidos juntos. Também são necessários para sintetizar a insulina são grandes tanques para cultivar as bactérias, e nutrientes são necessários para que as bactérias cresçam., Vários instrumentos são necessários para separar e purificar o DNA, como uma centrifugadora, juntamente com vários instrumentos de cromatografia e cristalografia de raios-X. o processo de fabrico
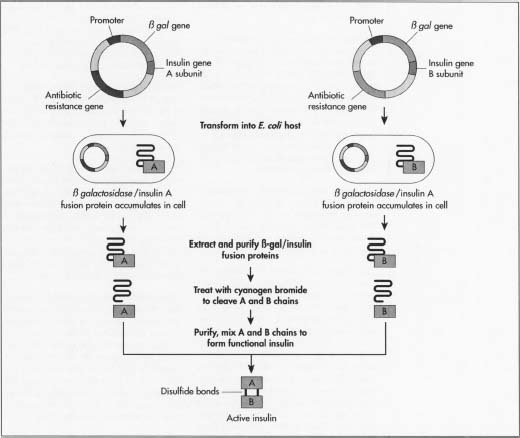
sintetizar a insulina humana é um processo bioquímico multifaseado que depende de técnicas básicas de ADN recombinante e da compreensão do gene da insulina. O DNA carrega as instruções para como o corpo funciona e um pequeno segmento do DNA, o gene da insulina, códigos para a insulina proteína. Os fabricantes manipulam o precursor biológico da insulina para que ela cresça dentro de bactérias simples., Embora os fabricantes tenham cada um as suas próprias variações, existem dois métodos básicos para o fabrico de insulina humana. o gene da insulina é uma proteína que consiste em duas cadeias separadas de aminoácidos, um A acima de uma cadeia B, que são mantidos junto com ligações. Aminoácidos são as unidades básicas que constroem todas as proteínas. A cadeia insulina A consiste em 21 aminoácidos e a cadeia B tem 30. 2 antes de se tornar uma proteína activa de insulina, a insulina é produzida pela primeira vez como preproinsulina., Esta é uma única longa cadeia proteica com as cadeias A E B ainda não separadas, uma seção no meio ligando as cadeias juntas e uma sequência de sinal em uma extremidade dizendo à proteína quando começar a segregar fora da célula. Após a preproinsulina, a cadeia evolui para a proinsulina, ainda uma única cadeia, mas sem a sequência sinalizadora. Em seguida, vem a insulina proteína ativa, a proteína sem a seção ligando as cadeias A E B. Em cada etapa, a proteína precisa de enzimas específicas (proteínas que realizam reações químicas) para produzir a próxima forma de insulina., um método de fabrico da insulina consiste em fazer crescer as duas cadeias de insulina separadamente. Isto evitará o fabrico de cada uma das enzimas específicas necessárias. Os fabricantes precisam dos dois mini-genes: um que produz a cadeia A e um para a cadeia B. Uma vez que a sequência exata de DNA de cada cadeia é conhecida, eles sintetizam o DNA de cada mini-gene em uma máquina de sequenciamento de aminoácidos.
insulina analógica
em meados dos anos 90, os investigadores começaram a melhorar a forma como a insulina humana funciona no organismo, alterando a sua sequência de aminoácidos e criando um análogo, uma substância química que imita uma outra substância suficientemente bem que engana a célula. A insulina analógica acumula-se menos e dispersa-se mais rapidamente no sangue, permitindo que a insulina comece a trabalhar no organismo minutos após uma injecção. Existem várias insulinas analógicas diferentes. A insulina Humulin não tem fortes ligações com outra insulina e, portanto, é absorvida rapidamente., Outra insulina analógica, chamada glargina, muda a estrutura química da proteína para fazer com que ela tenha uma libertação relativamente constante ao longo de 24 horas, sem picos pronunciados.
em vez de sintetizar a sequência exacta de ADN para a insulina, os fabricantes sintetizam um gene de insulina onde a sequência é ligeiramente alterada. A alteração causa o resultante
o futuro
o futuro da insulina tem muitas possibilidades. Uma vez que a insulina foi sintetizada pela primeira vez, os diabéticos precisavam de injectar regularmente a insulina líquida com uma seringa directamente na sua corrente sanguínea. Isto permite que a insulina entre no sangue imediatamente. Durante muitos anos foi a única forma conhecida de mover a proteína intacta para o organismo., Na década de 1990, pesquisadores começaram a fazer incursões na síntese de vários dispositivos e formas de insulina que os diabéticos podem usar em um sistema alternativo de entrega de drogas.
os fabricantes estão actualmente a produzir vários dispositivos de distribuição de medicamentos relativamente novos. As canetas de insulina parecem uma caneta para escrita. Um cartucho contém a insulina e a ponta é a agulha. O utilizador marcou a dose, insere a agulha na pele e pressiona um botão para injectar a insulina. Com as canetas não é necessário utilizar um frasco para injectáveis de insulina. No entanto, as canetas devem ser colocadas separadamente antes de cada injecção., Outra desvantagem é que a caneta não permite que os utilizadores misturem tipos de insulina, e nem toda a insulina está disponível.
para pessoas que odeiam agulhas, um alternativo à caneta é o jet-injector. Parecendo semelhantes às canetas, os injetores de jato usam pressão para impulsionar um pequeno fluxo de insulina através da pele. Estes dispositivos não são tão amplamente utilizados como a caneta, e eles podem causar contusões no ponto de entrada. a bomba de insulina permite uma libertação controlada no organismo. Esta é uma bomba computadorizada, do tamanho de um beeper, que os diabéticos podem usar no cinto ou no bolso., A bomba tem um pequeno tubo flexível que é inserido sob a superfície da pele do diabético. O diabético configura a bomba para administrar uma dose constante e medida de insulina durante todo o dia, aumentando a quantidade imediatamente antes de comer. Isto imita a libertação normal de insulina pelo organismo. Os fabricantes produzem bombas de insulina desde a década de 1980, mas os avanços no final da década de 1990 e início do século XXI tornaram-nas cada vez mais fáceis de usar e mais populares. Os investigadores estão a explorar a possibilidade de bombas de insulina implantáveis., Os diabéticos controlariam estes dispositivos através de um controlo remoto externo. os investigadores estão a explorar outras opções de distribuição de droga. Ingerir insulina através de comprimidos é uma possibilidade. O desafio com a insulina comestível é que o ambiente ácido do estômago destrói a proteína antes que ela possa se mover para o sangue. Pesquisadores estão trabalhando no revestimento de insulina com plástico a largura de alguns cabelos humanos. Os revestimentos protegeriam as drogas do ácido do estômago., em 2001, estão a ocorrer testes promissores em dispositivos de insulina inalada e os fabricantes poderão começar a produzir os produtos nos próximos anos. Uma vez que a insulina é uma proteína relativamente grande, não permeia para os pulmões. Pesquisadores de insulina inalada estão trabalhando para criar partículas de insulina que são pequenas o suficiente para alcançar o pulmão profundo. As partículas podem então passar para a corrente sanguínea. Os investigadores estão a testar vários dispositivos de inalação, como o inalador para asma. outra forma de dispositivo aerossol em testes irá administrar insulina na bochecha interior., Conhecido como insulina bucal (bochecha), diabéticos vai pulverizar a insulina no interior de sua bochecha. É então absorvida através da parede interna da bochecha. os sistemas transdérmicos de insulina são outro sistema de administração do fármaco em desenvolvimento. Os sistemas transdérmicos libertariam a insulina continuamente na corrente sanguínea. Os utilizadores puxariam uma aba no adesivo para libertar mais insulina antes das refeições. O desafio é encontrar uma maneira de fazer com que a insulina passe através da pele. O ultra-som é um método que os investigadores estão a investigar. Estas ondas sonoras de baixa frequência podem alterar a permeabilidade da pele e permitir a passagem da insulina., outras investigações podem descontinuar a necessidade de os fabricantes sintetizarem a insulina. Os pesquisadores estão trabalhando na criação das células que produzem insulina no laboratório. O pensamento é que os médicos podem um dia substituir as células do pâncreas que não funcionam por células produtoras de insulina. Outra esperança para os diabéticos é a terapia genética. Os cientistas estão a tentar corrigir a mutação do gene da insulina para que os diabéticos possam produzir insulina sozinhos.
M. Rae Nelson
Deixe uma resposta