Metoximetano has the same molecular formula, the same number of electrons, and roughly the same shape and size as ethanol. Apesar destas semelhanças, as fórmulas estruturais (a organização das moléculas individuais no espaço) são diferentes entre o etanol (CH3CH2OH) e o metoximetano (CH3OCH3). Esta diferença na configuração dos átomos dentro das moléculas tem um efeito dramático na volatilidade do etanol versus metoximetano.,
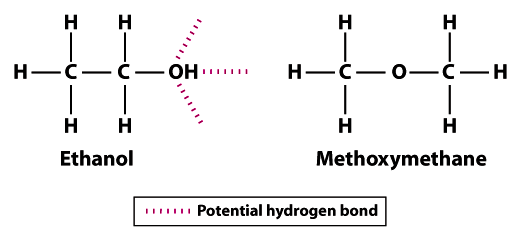 as estruturas mostram porque o etanol é menos volátil do que o metoximetano; o etanol pode formar três ligações de hidrogénio e o metoximetano não pode formar nenhuma.Note que os átomos de hidrogênio no metoximetano não podem participar da ligação de hidrogênio com átomos de oxigênio vizinhos. The hydrogen atom of the hydroxyl group (OH) in ethanol increases the potential for hydrogen bonding between neighboring ethanol molecules. Comparado com metoximetano, o etanol não é tão volátil. O ponto de ebulição de 78,5°C para o etanol é significativamente maior em comparação com -24.,8 ° C para o metoximetano. Este exemplo ilustra o significado da força de ligação em geral e da ligação de hidrogênio especificamente como um determinante da volatilidade de uma molécula.
as estruturas mostram porque o etanol é menos volátil do que o metoximetano; o etanol pode formar três ligações de hidrogénio e o metoximetano não pode formar nenhuma.Note que os átomos de hidrogênio no metoximetano não podem participar da ligação de hidrogênio com átomos de oxigênio vizinhos. The hydrogen atom of the hydroxyl group (OH) in ethanol increases the potential for hydrogen bonding between neighboring ethanol molecules. Comparado com metoximetano, o etanol não é tão volátil. O ponto de ebulição de 78,5°C para o etanol é significativamente maior em comparação com -24.,8 ° C para o metoximetano. Este exemplo ilustra o significado da força de ligação em geral e da ligação de hidrogênio especificamente como um determinante da volatilidade de uma molécula.
Deixe uma resposta