Not long after G. N. Lewis popularized the electron-dot model, quantum mechanics became a very powerful model, including its use to describe the chemical bond. Dois modelos — o modelo de ligação de Valência e o modelo orbital molecular–foram desenvolvidos quase simultaneamente. Linus Pauling tornou-se o campeão do modelo valence bond, que é mais fácil de visualizar e usar. Este modelo é essencialmente uma versão mecânica quântica do modelo elétron-ponto: ele tenta descrever quais orbitais são usados por cada átomo quando elétrons são compartilhados., Por exemplo, quando a molécula simples H2 é formada a partir de átomos de hidrogênio, o modelo de ligação de Valência diz que um s-orbital em um átomo se sobrepõe com um s-orbital no outro para formar uma ligação. Isto é por vezes representado por um diagrama de sobreposição e uma imagem como mostrado na Figura 30.

Figura 30. Diagrama de sobreposição e imagem para a descrição da ligação de Valência do hidrogénio diatómico.,
um dos problemas que Pauling encontrou no início de seus esforços pioneiros com a teoria da ligação de Valência é claramente exemplificado por uma simples imagem da ligação de Valência na água. A Figura 31 mostra dois orbitais p sobre sobreposição de oxigénio com orbitais s em hidrogénios. Esta imagem mostra claramente que o ângulo de ligação na água deve ser de 90°, porque os dois orbitais p estão alinhados ao longo dos eixos x e y e são, portanto, perpendiculares.

Figura 31. Sobreposição Orbital na água.,
na verdade, o ângulo de ligação na água é de 105°, um desvio significativo de 90°. Este tipo de erro pode não parecer significativo para você, mas para alguém tentando formular um modelo que irá explicar o máximo de uma certa parte da natureza possível, esta diferença entre teoria e fato experimental é muito incomodativa. Pauling então adicionou outra modificação à teoria — hibridização., Pauling disse que atômicos orbitais em um átomo não são sagrados, eles são só um conjunto de equações matemáticas (lembre-se de nossa discussão sobre o modelo de onda) que pode ser usado para descrever os elétrons no átomo. Outros conjuntos podem ser gerados Adicionando e subtraindo esses orbitais atômicos de acordo com certas regras. Assim, se um orbital s e os três orbitais p são combinados matematicamente, um novo conjunto de orbitais, sp3 orbitais, são gerados. O novo conjunto de orbitais Tem características orientacionais diferentes do conjunto de orbitais atômicos., A figura 32 mostra os s e três p-orbitais em parte (a) e, em seguida, em parte (b) os quatro novos híbridos sp3. Como podem ver, estes híbridos sp3 são orientados para os cantos de um tetraedro. A figura 33 mostra esses híbridos sendo usados para descrever a ligação na água. Como o ângulo entre os híbridos é de 109°, agora esperamos que o ângulo de ligação na água seja de 109°. É evidente que isso nos dá uma melhor concordância com o valor experimental de 105°. (Note que isso não está em perfeito acordo, mas é o melhor que podemos fazer.,) Outras combinações de hibridação também são possíveis, e estas são resumidas na figura 34.

figura 32. hibridização sp3.
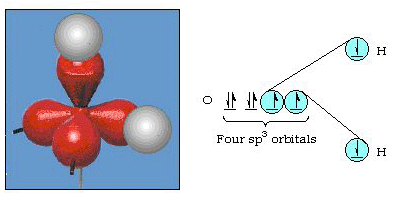
Figura 33. Utilização de híbridos sp3 para explicar o ângulo de ligação na água.
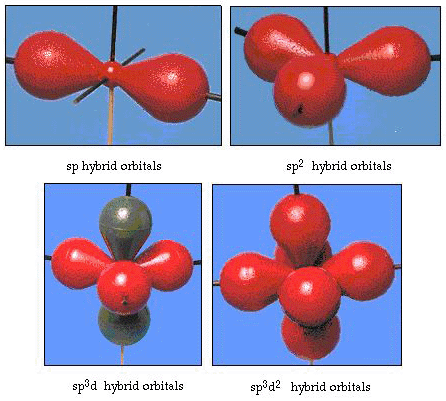
Figura 34. Outros esquemas de hibridação.
press for video
There is one other feature of the valence bond model that deserves discussion. É bem ilustrado pela nossa molécula familiar de oxigénio, O2., A figura 35 mostra a sobreposição de dois orbitais px para nos dar uma única ligação. Se queremos obedecer à regra octeto, também devemos formar outro vínculo. Isto deve ser por sobreposição de dois orbitais py ou dois PZ (não importa qual). Esta ligação tem sua densidade de elétrons acima e abaixo da linha internuclear, ao invés de diretamente entre os dois núcleos de oxigênio. Esta ligação é referida como uma ligação 1, enquanto que a que coloca a densidade de elétrons entre os átomos é chamada de ligação sigma (σ)., Uma das consequências interessantes desta imagem é que a ligação de 1 é esperada para ser mais fraca do que a ligação de sigma (a sobreposição dos orbitais é mais fraca). Isto significa que uma ligação dupla não tem a força de duas ligações únicas e também é mais suscetível a ataques por átomos externos que estão procurando por densidade de elétrons.

figura 35. Formação de ligações sigma e pi em oxigénio diatómico.,
como um exemplo final do tratamento da ligação de valência da ligação, a figura 36 mostra uma imagem dos orbitais envolvidos na ligação em eteno, o hidrocarboneto insaturado mais simples (H2C=CH2). Experimentalmente, tem sido mostrado que os ângulos de ligação em torno de cada carbono são quase 120°. Assim, nossa imagem mostra o uso de híbridos sp2 (porque eles têm ângulos de 120° entre si) para a construção das ligações sigma. A ligação 1 é formada por sobreposição de dois orbitais pz. É importante notar que a ligação 1 introduz uma barreira à rotação sobre a ligação carbono-carbono., Isto é, se um grupo CH2 fosse rodar, a ligação 1 teria que ser quebrada, o que exigiria energia considerável. A consequência disso é que a ligação 1 fixa os dois grupos CH2 em um plano, fazendo com que a molécula global seja planar.

figura 36. A ligação em eteno.
o modelo orbital molecular tem uma abordagem diferente. Ele utiliza todos os orbitais em todos os átomos para gerar um conjunto de orbitais que se estendem sobre todos os átomos da molécula inteira., O modelo orbital molecular é mais difícil de visualizar, mas também é mais poderoso. O difícil processo de determinar como combinar os órgãos genitais atômicos para gerar orbitais moleculares é agora feito por computador para até moléculas grandes. O químico praticante usa o modelo orbital molecular para prever espectros, estados de transição, etc., but for everyday chemical discussions, the electron-dot and valence bond models still rule the day.
Deixe uma resposta