Metoximetanul are aceeași formulă moleculară, același număr de electroni, și aproximativ aceeași formă și dimensiune ca etanol. În ciuda acestor asemănări, formulele structurale (organizarea de molecule individuale în spațiu) sunt diferite între etanol (CH3CH2OH) și methoxymethane (CH3OCH3). Această diferență în configurația atomilor din molecule are un efect dramatic asupra volatilității etanolului față de metoximetan.,
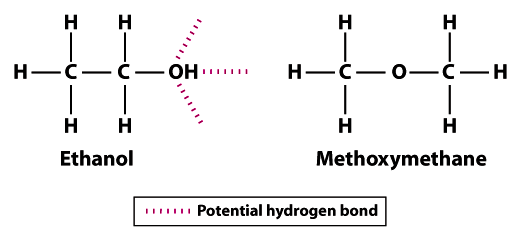 structurile arăta de ce etanolul este mai puțin volatil decât methoxymethane; etanolului se poate forma trei legături de hidrogen și methoxymethane nu se poate forma orice.Rețineți că atomii de hidrogen din metoximetan nu pot participa la legarea hidrogenului cu atomii de oxigen vecini. Atomul de hidrogen al grupării hidroxil (OH) din etanol crește potențialul de legare a hidrogenului între moleculele de etanol vecine. Comparativ cu metoximetanul, etanolul nu este la fel de Volatil. Punctul de fierbere de 78,5°C pentru etanol este semnificativ mai mare comparativ cu -24.,8°C pentru metoximetan. Acest exemplu ilustrează semnificația rezistenței legăturii în general și a legăturii de hidrogen în mod specific ca determinant al volatilității unei molecule.
structurile arăta de ce etanolul este mai puțin volatil decât methoxymethane; etanolului se poate forma trei legături de hidrogen și methoxymethane nu se poate forma orice.Rețineți că atomii de hidrogen din metoximetan nu pot participa la legarea hidrogenului cu atomii de oxigen vecini. Atomul de hidrogen al grupării hidroxil (OH) din etanol crește potențialul de legare a hidrogenului între moleculele de etanol vecine. Comparativ cu metoximetanul, etanolul nu este la fel de Volatil. Punctul de fierbere de 78,5°C pentru etanol este semnificativ mai mare comparativ cu -24.,8°C pentru metoximetan. Acest exemplu ilustrează semnificația rezistenței legăturii în general și a legăturii de hidrogen în mod specific ca determinant al volatilității unei molecule.
Lasă un răspuns