Un subnivel este un nivel de energie definit de teoria cuantică.În chimie, subnivele se referă la energiile asociate cu electroni.În fizică, subnivele pot, de asemenea, se referă la energiile asociate cu nucleul.,
Niels Bohr primele teoria cuantică a spus că electronii ocupă scoici sferice centrate pe nucleul atomic, cum ar fi cele două coji de electroni afișate pentru litiu de mai jos:
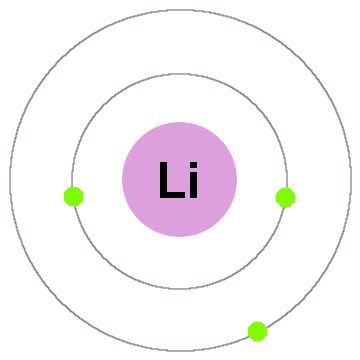
În această coajă vechi model de mișcare pasivă:
- Shell 1 poate stoca până la 2 electroni,
- Shell 2 poate stoca până la 8 electroni,
- Shell 3 poate stoca până la 18 electroni,
- Shell 4 poate stoca până la 32 de electroni,
- Shell 5 poate stoca până la 50 de electroni…fiecare coajă este de fapt un nivel de energie., Cu cât este mai mare cochilia, cu atât este mai mare energia electronului(electronilor). Toți electronii care împart o cochilie sunt degenerați, ceea ce înseamnă că au aceeași cantitate de energie.progresele în spectroscopie au arătat că cojile pot conține de fapt subshell-uri/subniveluri.Electronii din shell 3, de exemplu, ar putea avea cantități diferite de energie unul față de celălalt, deoarece ocupă subniveluri diferite.
diagrama nivelului de energie de mai jos arată subnivele la fel de mari ca nivelul de energie al orbitalilor 5f.,Subsolurile continuă de fapt la energii mai mari decât aceasta, dar 5f este un loc potrivit pentru a lăsa o descriere introductivă.
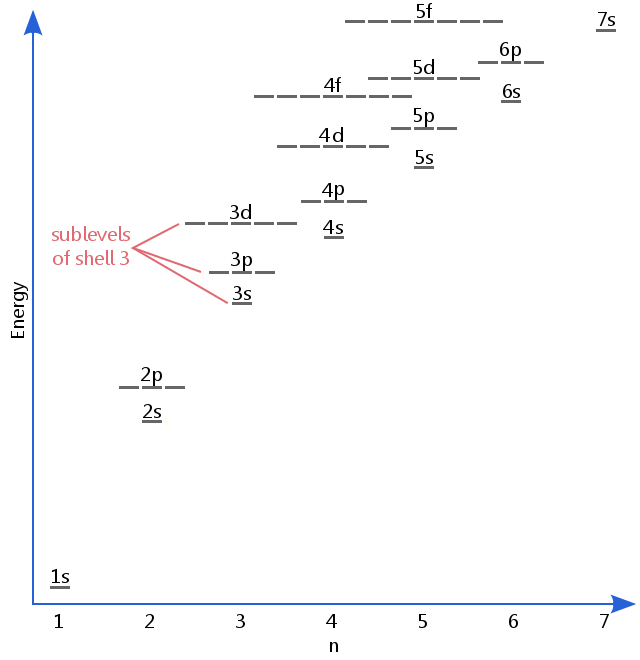
 Numirea Subshells/Subnivele
Numirea Subshells/SubniveleElectron subnivele sunt cunoscute prin literele s, p, d, și f.Astfel, de exemplu, electronii în s subnivelul de coajă 3 au o cantitate diferită de energie de electroni în p și d nivelurile de coajă 3.(Nu este cazul hidrogenului., Toate subsolurile hidrogenului au aceeași energie, deoarece hidrogenul are un singur electron.)
S, P, d și F subnivele
subnivelul ocupat de orice electron este determinat de numărul cuantic al momentului unghiular al electronului, l.,div id=”7de4153d3c”>
The energy level diagram excerpt below shows the sublevels corresponding to different values of l in the fourth electron shell.,
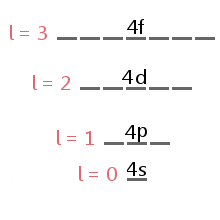
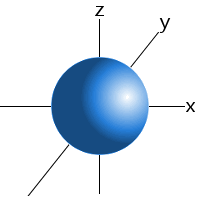
orbitalii subnivel au forme caracteristice care pot fi folosite pentru a explica și prezice legăturile chimice pe care atomii le pot forma.Aceste forme se bazează pe probabilitatea de a găsi un electron în orice locație particulară care orbitează nucleul.de exemplu, putem spune că un electron din subnivelul 1s al unui atom de hidrogen va fi găsit 99% din timp undeva într-o sferă cu o rază dată în jurul nucleului.Acesta este motivul pentru care putem desena orbitalii subnivelului s ca sferă.,
Orbitalii pentru subnivele superioare sunt, de asemenea, trase pe baza în cazul în care electronii unui atom sunt cel mai probabil să fie găsite. A se vedea orbitals pentru mai multe detalii.
Un s subnivel orbital
Subnivel Exemple
Exemple de subnivele găsite în diferite atomii sunt prezentate mai jos. Superscript arată numărul de electroni din fiecare subnivel.
Hidrogen: 1s1
de Carbon: 1s2 2s2 2p2
Clor: 1s2 2s2 2p6 3s2 3p5
Argon: 1s2 2s2 2p6 3s2 3p6
În general, electronii pleacă în cel mai mic disponibil energie subnivel., Ordinea generală în care subnivele sunt umplute este:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Având în vedere acest lucru, putem răspunde la întrebări de genul: „ce sunt de potasiu este de electroni subnivele?potasiul are 19 electroni și știm că orbitalii s dețin maximum doi electroni și p maximum șase. Subsolurile de electroni ale potasiului vor fi:

Lasă un răspuns