fundal
insulina este un hormon care reglează cantitatea de glucoză (zahăr) din sânge și este necesară pentru ca organismul să funcționeze normal. Insulina este produsă de celulele din pancreas, numite insulele Langerhans. Aceste celule eliberează continuu o cantitate mică de insulină în organism, dar eliberează creșteri ale hormonului ca răspuns la o creștere a nivelului de glucoză din sânge., anumite celule din organism schimbă alimentele ingerate în energie sau glucoza din sânge pe care celulele le pot folosi. De fiecare dată când o persoană mănâncă, glicemia crește. Glicemia crescută declanșează celulele din insulele Langerhans pentru a elibera cantitatea necesară de insulină. Insulina permite transportul glucozei din sânge în celule. Celulele au un perete exterior, numit membrană, care controlează ceea ce intră și iese din celulă. Cercetătorii nu știu încă exact cum funcționează insulina, dar știu că insulina se leagă de receptorii de pe membrana celulei., Aceasta activează un set de molecule de transport, astfel încât glucoza și proteinele să poată intra în celulă. Celulele pot folosi apoi glucoza ca energie pentru a-și îndeplini funcțiile. Odată transportat în celulă, nivelul glicemiei este readus la normal în câteva ore. fără insulină, glicemia se acumulează în sânge, iar celulele sunt înfometate de sursa lor de energie. Unele dintre simptomele care pot apărea includ oboseală, infecții constante, vedere încețoșată a ochilor, amorțeală, furnicături la nivelul mâinilor sau picioarelor, sete crescută și vindecarea încetinită a vânătăilor sau tăieturilor., Celulele vor începe să utilizeze grăsime, sursa de energie stocată pentru Situații de urgență. Când acest lucru se întâmplă prea mult timp, organismul produce cetone, substanțe chimice produse de ficat. Cetonele pot otrăvi și ucide celulele dacă se acumulează în organism pe o perioadă lungă de timp. Acest lucru poate duce la boli grave și comă. persoanele care nu produc cantitatea necesară de insulină au diabet. Există două tipuri generale de diabet. Cel mai sever tip, cunoscut sub numele de diabet de tip I sau debut juvenil, este atunci când organismul nu produce insulină., Diabetul de tip I se injectează de obicei cu diferite tipuri de insulină de trei până la patru ori pe zi. Dozajul este luat pe baza citirii glicemiei persoanei, luată de la un glucometru. Diabetul de tip II produce o anumită insulină, dar fie nu este suficient, fie celulele lor nu răspund în mod normal la insulină. Acest lucru apare de obicei la persoanele obeze sau de vârstă mijlocie și în vârstă. Diabetul de tip II nu trebuie neapărat să ia insulină, dar poate injecta insulină o dată sau de două ori pe zi.,
există patru tipuri principale de insulină fabricate în funcție de cât de repede începe să acționeze insulina, când atinge vârfuri și cât durează în organism. Potrivit American Diabetes Association, insulina cu acțiune rapidă ajunge în sânge în 15 minute, vârfuri la 30-90 de minute și poate dura cinci ore. Insulina cu acțiune scurtă ajunge în sânge în 30 de minute, atinge aproximativ două până la patru ore mai târziu și rămâne în sânge timp de patru până la opt ore., Insulina cu acțiune intermediară ajunge în sânge la două până la șase ore după injectare, atinge vârfuri de patru până la 14 ore mai târziu și poate dura în sânge timp de 14-20 de ore. Și insulina cu acțiune lungă durează șase până la 14 ore pentru a începe să funcționeze, are un vârf mic la scurt timp după aceea și rămâne în sânge timp de 20-24 de ore. Diabeticii au fiecare răspunsuri diferite la și nevoile de insulină, astfel încât nu există un tip care să funcționeze cel mai bine pentru toată lumea. Unele tipuri de insulină sunt vândute împreună cu două tipuri amestecate într-o singură sticlă., dacă organismul nu produce insulină sau suficientă, oamenii trebuie să ia o versiune fabricată a acestuia. Utilizarea majoră a producerii de insulină este pentru diabetici care nu fac suficientă sau orice insulină în mod natural. înainte ca cercetătorii să descopere cum să producă insulină, persoanele care sufereau de diabet de tip I nu aveau nicio șansă pentru o viață sănătoasă. Apoi, în 1921, oamenii de știință canadieni Frederick G. Banting și Charles H. au purificat cu succes insulina din pancreasul unui câine. De-a lungul anilor, oamenii de știință au făcut îmbunătățiri continue în producerea insulinei., În 1936, cercetătorii au găsit o modalitate de a face insulină cu o eliberare mai lentă în sânge. Au adăugat o proteină găsită în sperma de pește, protamina, pe care organismul o descompune încet. O injecție a durat 36 de ore. O altă descoperire a venit în 1950, când cercetătorii au produs un tip de insulină care a acționat puțin mai repede și nu rămâne în sânge atâta timp. În anii 1970, cercetătorii au început să încerce să producă o insulină care să imite mai mult modul în care funcționează insulina naturală a organismului: eliberând o cantitate mică de insulină toată ziua, cu supratensiuni care apar la mese., cercetătorii au continuat să îmbunătățească insulina, dar metoda de producție de bază a rămas aceeași de zeci de ani. Insulina a fost extrasă din pancreasul bovinelor și porcilor și purificată. Structura chimică a insulinei la aceste animale este doar puțin diferită de insulina umană, motiv pentru care funcționează atât de bine în corpul uman. (Deși unii oameni au avut sistem imunitar negativ sau reacții alergice.) Apoi, la începutul anilor 1980, biotehnologia a revoluționat sinteza insulinei. Cercetătorii au decodat deja structura chimică a insulinei la mijlocul anilor 1950., Ei au determinat în curând locația exactă a genei insulinei în partea de sus a cromozomului 11. Până în 1977, o echipă de cercetare a îmbinat o genă de insulină de șobolan într-o bacterie care a produs apoi insulină.

Început în Mai 1921, Banting și Best legat de pe conductele pancreatice la câini, astfel încât celulele acinare-ar atrofia, apoi eliminat pancresul pentru a extrage lichid din celule insulare. Între timp, au îndepărtat pancreasul de la alți câini pentru a provoca diabet, apoi au injectat lichidul celulelor insulei. În ianuarie 1922, Leonard Thompson, în vârstă de 14 ani, a devenit primul om care a fost tratat cu succes pentru diabet folosind insulină. cel mai bun a primit diploma medicală în 1925., Banting a insistat cel mai bun, de asemenea, să fie creditat, și aproape a refuzat premiul Nobel, deoarece cel mai bun nu a fost inclus. Cel mai bun a devenit șef al Departamentului de fiziologie al Universității din Toronto în 1929 și director al Banting universității și cel mai bun departament de cercetare medicala dupa moartea lui Banting în 1941. în anii 1980, cercetătorii au folosit ingineria genetică pentru fabricarea unei insuline umane. În 1982, Corporația Eli Lilly a produs o insulină umană care a devenit primul produs farmaceutic aprobat prin inginerie genetică., Fără a fi nevoie să depindă de animale, cercetătorii ar putea produce insulină modificată genetic în cantități nelimitate. De asemenea, nu conținea nici unul dintre contaminanții animalelor. Utilizarea insulinei umane a eliminat, de asemenea, orice îngrijorare cu privire la transferarea în insulină a oricăror boli potențiale la animale. În timp ce companiile încă vând o cantitate mică de insulină produsă de animale—în mare parte porcină—începând cu anii 1980, utilizatorii de insulină au trecut din ce în ce mai mult la o formă de insulină umană creată prin tehnologia ADN-ului recombinant., Potrivit Eli Lilly Corporation, în 2001, 95% dintre utilizatorii de insulină din majoritatea părților lumii iau o formă de insulină umană. Unele companii au încetat să producă complet insulină animală. Companiile se concentrează pe sintetizarea insulinei umane și a analogilor de insulină, o modificare a moleculei de insulină într-un fel.
materii prime
insulina umană este cultivată în laborator în interiorul bacteriilor comune. Escherichia coli este de departe cel mai utilizat tip de bacterie, dar se folosește și drojdie. cercetătorii au nevoie de proteina umană care produce insulină., Producătorii obțin acest lucru printr-o mașină de secvențiere a aminoacizilor care sintetizează ADN-ul. Producătorii cunosc ordinea exactă a aminoacizilor insulinei (moleculele pe bază de azot care se aliniază pentru a alcătui proteinele). Există 20 de aminoacizi comuni. Producătorii introduc aminoacizii insulinei, iar mașina de secvențiere conectează aminoacizii împreună. De asemenea, necesare pentru a sintetiza insulina sunt rezervoare mari pentru a crește bacteriile, iar nutrienții sunt necesari pentru ca bacteriile să crească., Mai multe instrumente sunt necesare pentru separarea și purificarea ADN-ului, cum ar fi o centrifugă, împreună cu diverse instrumente de cromatografie și cristalografie cu raze X.
procesul de fabricație
sintetizarea insulinei umane este un proces biochimic în mai multe etape care depinde de tehnicile de bază ale ADN-ului recombinant și de înțelegerea genei insulinei. ADN-ul poartă instrucțiunile pentru modul în care funcționează organismul și un mic segment al ADN-ului, gena insulinei, codifică insulina proteică. Producătorii manipulează precursorul biologic al insulinei, astfel încât să crească în interiorul bacteriilor simple., În timp ce producătorii au fiecare propriile variații, există două metode de bază pentru fabricarea insulinei umane.
lucrul cu insulina umană
- 1 gena insulinei este o proteină formată din două lanțuri separate de aminoacizi, un A deasupra unui lanț B, care sunt ținute împreună cu legăturile. Aminoacizii sunt unitățile de bază care construiesc toate proteinele. Lanțul de insulină A este format din 21 de aminoacizi, iar lanțul B are 30.
- 2 înainte de a deveni o proteină insulinică activă, insulina este produsă mai întâi sub formă de preproinsulină., Acesta este un singur lanț proteic lung cu lanțurile A și B care nu sunt încă separate, o secțiune în mijloc care leagă lanțurile împreună și o secvență de semnal la un capăt care spune proteinei când să înceapă să secrete în afara celulei. După preproinsulină, lanțul evoluează în proinsulină, încă un singur lanț, dar fără secvența de semnalizare. Apoi vine proteina activă insulină, proteina fără secțiunea care leagă lanțurile A și B. La fiecare pas, proteina are nevoie de enzime specifice (proteine care efectuează reacții chimice) pentru a produce următoarea formă de insulină.,
începând cu A și B
- 3 o metodă de fabricare a insulinei constă în creșterea separată a celor două lanțuri de insulină. Acest lucru va evita fabricarea fiecăreia dintre enzimele specifice necesare. Producătorii au nevoie de cele două mini-gene: una care produce lanțul A și una pentru lanțul B. Deoarece secvența ADN exactă a fiecărui lanț este cunoscută, ele sintetizează ADN-ul fiecărei mini-gene într-o mașină de secvențiere a aminoacizilor.
- 4 aceste două molecule de ADN sunt apoi inserate în plasmide, mici bucăți circulare de ADN care sunt mai ușor preluate de ADN-ul gazdei.,
- 5 producătorii introduc mai întâi plasmidele într-un tip non-dăunător al bacteriei E. coli. Îl introduc lângă gena lacZ. LacZ codifică pentru 8-galactozidază, o genă utilizată pe scară largă în procedurile ADN recombinant, deoarece este ușor de găsit și tăiat, permițând îndepărtarea ușoară a insulinei, astfel încât să nu se piardă în ADN-ul bacteriei. Alături de această genă este aminoacidul metionină, care începe formarea proteinelor.
- 6 plasmidele recombinante, nou formate, sunt amestecate cu celulele bacteriene. Plasmidele intră în bacterii într-un proces numit transfecție., Producătorii pot adăuga celulelor ADN ligază, o enzimă care acționează ca un adeziv pentru a ajuta plasmida să se lipească de ADN-ul bacteriei.
- 7 bacteriile care sintetizează insulina suferă apoi un proces de fermentare. Sunt cultivate la temperaturi optime în rezervoare mari din fabricile de producție. Milioanele de bacterii se reproduc aproximativ la fiecare 20 de minute prin mitoza celulară și fiecare exprimă gena insulinei.
- 8 după înmulțire, celulele sunt scoase din rezervoare și rupte pentru a extrage ADN-ul., O modalitate obișnuită de a face acest lucru este adăugarea mai întâi a unui amestec de lizozom care digeră stratul exterior al peretelui celular, apoi adăugarea unui amestec de detergent care separă membrana peretelui celular gras. ADN-ul bacteriei este apoi tratat cu bromură de cianogen, un reactiv care împarte lanțurile proteice la reziduurile de metionină. Aceasta separă lanțurile de insulină de restul ADN-ului.
- 9 cele două lanțuri sunt apoi amestecate și unite prin legături disulfidice prin reacția de reducere-reoxidare. Se adaugă un agent oxidant (un material care provoacă oxidarea sau transferul unui electron)., Lotul este apoi plasat într-o centrifugă, un dispozitiv mecanic care se rotește rapid pentru a separa componentele celulare după dimensiune și densitate.
- 10 amestecul de ADN este apoi purificat astfel încât să rămână doar lanțurile de insulină. Producătorii pot purifica amestecul prin mai multe tehnici de cromatografie sau separare care exploatează diferențele în sarcina, dimensiunea și afinitatea moleculei față de apă. Procedurile utilizate includ o coloană de schimb de ioni, cromatografie lichidă de înaltă performanță în fază inversă și o coloană de cromatografie cu filtrare în gel., Producătorii pot testa loturile de insulină pentru a se asigura că niciuna dintre proteinele E. coli ale bacteriilor nu este amestecată cu insulina. Ei folosesc o proteină marker care le permite să detecteze ADN-ul E. coli. Ei pot determina apoi că procesul de purificare elimină bacteriile E. coli.
procesul de proinsulină
- 11 începând din 1986, producătorii au început să utilizeze o altă metodă pentru a sintetiza insulina umană. Au început cu precursorul direct al genei insulinei, proinsulina., Multe dintre etape sunt aceleași ca atunci când se produce insulină cu lanțurile A și B, cu excepția acestei metode mașina de aminoacizi sintetizează gena proinsulinei.
- 12 secvența care codifică proinsulina este introdusă în bacteriile nepatogene E. coli. Bacteriile trec prin procesul de fermentare unde reproduce și produce proinsulină. Apoi secvența de legătură între lanțurile A și B este îmbinată cu o enzimă și insulina rezultată este purificată.,
- 13 la sfârșitul procesului de fabricație ingredientele sunt adăugate la insulină pentru a preveni bacteriile și pentru a ajuta la menținerea unui echilibru neutru între acizi și baze. Ingredientele sunt, de asemenea, adăugate la insulina cu acțiune intermediară și de lungă durată pentru a produce tipul de insulină dorit. Aceasta este metoda tradițională de producere a insulinei cu acțiune mai lungă. Producătorii adaugă ingrediente la insulina purificată care își prelungesc acțiunile, cum ar fi oxidul de zinc. Acești aditivi întârzie absorbția în organism. Aditivii variază între diferite mărci de același tip de insulină., la mijlocul anilor 1990, cercetătorii au început să îmbunătățească modul în care funcționează insulina umană în organism, schimbând secvența de aminoacizi și creând un analog, o substanță chimică care imită o altă substanță suficient de bine încât să păcălească celula. Insulina analogică se acumulează mai puțin și se dispersează mai ușor în sânge, permițând insulinei să înceapă să acționeze în organism la câteva minute după o injecție. Există mai multe insuline analogice diferite. Insulina Humulin nu are legături puternice cu alte insuline și, prin urmare, este absorbită rapid., Un alt analog de insulină, numit glargin, modifică structura chimică a proteinei pentru a o face să aibă o eliberare relativ constantă pe parcursul a 24 de ore, fără vârfuri pronunțate.
în loc să sintetizeze secvența exactă a ADN-ului pentru insulină, producătorii sintetizează o genă de insulină în care secvența este ușor modificată. Modificarea determină
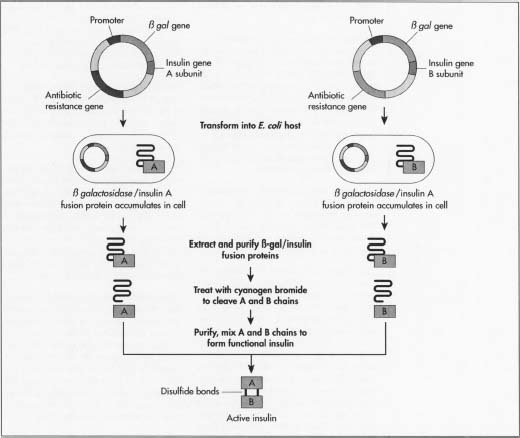 o diagramă a etapelor de fabricație a insulinei.
o diagramă a etapelor de fabricație a insulinei.proteine pentru a se respinge reciproc, ceea ce provoacă mai puțină aglomerare., Folosind această secvență ADN modificată, procesul de fabricație este similar cu procesul ADN recombinant descris.
controlul calității
după sintetizarea insulinei umane, structura și puritatea loturilor de insulină sunt testate prin mai multe metode diferite. Cromatografia lichidă de înaltă performanță este utilizată pentru a determina dacă există impurități în insulină. Alte tehnici de separare, cum ar fi cristalografia cu raze X, filtrarea cu gel și secvențierea aminoacizilor, sunt de asemenea efectuate. De asemenea, producătorii testează ambalajul flaconului pentru a se asigura că este sigilat corespunzător., fabricarea insulinei umane trebuie să respecte procedurile Institutului Național de sănătate pentru operațiile la scară largă. Administrația Statelor Unite pentru alimente și medicamente trebuie să aprobe toată insulina fabricată.
viitorul
viitorul insulinei deține multe posibilități. Deoarece insulina a fost sintetizată pentru prima dată, diabeticii au trebuit să injecteze regulat insulina lichidă cu o seringă direct în fluxul sanguin. Aceasta permite insulinei să intre imediat în sânge. Timp de mulți ani a fost singura modalitate cunoscută de a muta proteina de insulină intactă în organism., În anii 1990, cercetătorii au început să facă incursiuni în sinteza diferitelor dispozitive și forme de insulină pe care diabeticii le pot folosi într-un sistem alternativ de administrare a medicamentelor.
producătorii produc în prezent mai multe dispozitive relativ noi de livrare a medicamentelor. Stilourile cu insulină arată ca un stilou de scris. Un cartuș conține insulina, iar vârful acului. Utilizatorul fixează o doză, introduce acul în piele și apasă un buton pentru a injecta insulina. Cu stilouri nu este nevoie să utilizați un flacon de insulină. Cu toate acestea, pixuri necesită introducerea separată sfaturi înainte de fiecare injecție., Un alt dezavantaj este că stiloul nu permite utilizatorilor să amestece tipurile de insulină și nu toată insulina este disponibilă. pentru persoanele care urăsc acele, o alternativă la stilou este injectorul cu jet. Arătând similar stilourilor, injectoarele cu jet utilizează presiune pentru a propulsa un mic flux de insulină prin piele. Aceste dispozitive nu sunt la fel de utilizate pe scară largă ca stiloul și pot provoca vânătăi la punctul de intrare. pompa de insulină permite o eliberare controlată în organism. Aceasta este o pompă computerizată, cam de mărimea unui beeper, pe care diabeticii o pot purta pe centură sau în buzunar., Pompa are un mic tub flexibil care este introdus chiar sub suprafața pielii diabetice. Diabeticul setează Pompa pentru a elibera o doză constantă, măsurată de insulină pe parcursul zilei, crescând cantitatea chiar înainte de a mânca. Aceasta imită eliberarea normală de insulină a organismului. Producătorii au produs pompe de insulină din anii 1980, dar progresele înregistrate la sfârșitul anilor 1990 și începutul secolului XXI le-au făcut din ce în ce mai ușor de utilizat și mai populare. Cercetătorii explorează posibilitatea pompelor de insulină implantabile., Diabeticii ar controla aceste dispozitive printr-o telecomandă externă.
cercetătorii explorează alte opțiuni de livrare a medicamentelor. Ingerarea insulinei prin pastile este o posibilitate. Provocarea cu insulina comestibilă este că mediul acid ridicat al stomacului distruge proteina înainte de a se putea deplasa în sânge. Cercetătorii lucrează la acoperirea insulinei cu plastic cu lățimea câtorva fire de păr umane. Învelișurile ar proteja medicamentele de acidul stomacului., în 2001 au loc teste promițătoare pe dispozitivele de insulină inhalate, iar producătorii ar putea începe să producă produsele în următorii câțiva ani. Deoarece insulina este o proteină relativ mare, ea nu pătrunde în plămâni. Cercetătorii insulinei inhalate lucrează pentru a crea particule de insulină suficient de mici pentru a ajunge la plămânul profund. Particulele pot trece apoi în sânge. Cercetătorii testează mai multe dispozitive de inhalare asemănătoare cu cea a unui inhalator de astm. o altă formă de dispozitiv de aerosol supus testelor va administra insulină pe obrazul interior., Cunoscută sub numele de insulină bucală (obraz), diabeticii vor pulveriza insulina pe interiorul obrazului. Acesta este apoi absorbit prin peretele interior al obrazului. plasturii de insulină sunt un alt sistem de administrare a medicamentelor în dezvoltare. Plasturii ar elibera insulina continuu în sânge. Utilizatorii ar trage o filă pe plasture pentru a elibera mai multă insulină înainte de mese. Provocarea este de a găsi o modalitate de a avea insulina trece prin piele. Ecografia este o metodă pe care cercetătorii o investighează. Aceste unde sonore de joasă frecvență ar putea schimba permeabilitatea pielii și ar permite trecerea insulinei., alte cercetări au potențialul de a întrerupe necesitatea producătorilor de a sintetiza insulina. Cercetatorii lucreaza la crearea celulelor care produc insulina in laborator. Gândul este că medicii pot înlocui într-o zi celulele pancreasului care nu funcționează cu celule producătoare de insulină. O altă speranță pentru diabetici este terapia genică. Oamenii de știință lucrează la corectarea mutației genei insulinei, astfel încât diabeticii să poată produce insulină pe cont propriu.
M. Rae Nelson
Lasă un răspuns