Obiectiv de Învățare
- a Discuta despre proprietăți de azot.
puncte cheie
- azotul este un element chimic cu simbolul N și numărul atomic 7. Azotul elementar este un gaz diatomic incolor, inodor, insipid și mai ales inert în condiții standard, constituind 78,09% din atmosfera Pământului în volum.,
- gazul de azot este un gaz industrial produs prin distilarea fracționată a aerului lichid sau prin mijloace mecanice folosind aer gazos. Azotul comercial este adesea un produs secundar al procesării aerului pentru concentrația industrială de oxigen.
- azotul gazos are o varietate de aplicații, inclusiv servind ca un înlocuitor inert pentru aer în care oxidarea este nedorită. Azotul lichid este, de asemenea, utilizat pentru înghețarea criogenică a obiectelor.
Termeni
- elementalOf, referitoare la, sau fiind un element (spre deosebire de un compus).,
- aminoacidîn general, molecule care conțin atât o grupare funcțională amino, cât și o grupare funcțională a acidului carboxilic. Monomerii din care sunt construite lanțurile polipeptidice sau proteinele sunt aminoacizi.
- nitrogenun element chimic (simbol N) cu un număr atomic de 7 și o greutate atomică de 14.0067 amu.elementul azot a fost descoperit ca o componentă separabilă a aerului de către medicul scoțian Daniel Rutherford în 1772. Compușii de azot au fost bine cunoscuți în Evul Mediu. Alchimiștii știau acidul azotic ca aqua fortis (apă puternică)., Amestecul de acizi azotați și clorhidrici a fost cunoscut sub numele de aqua regia (apa Regală), sărbătorită pentru capacitatea sa de a dizolva aurul (regele metalelor). Cele mai vechi aplicații militare, industriale și agricole ale compușilor de azot au folosit salpetru (nitrat de sodiu sau nitrat de potasiu), mai ales în praful de pușcă și mai târziu ca îngrășământ.azotul este un element chimic cu simbolul N și numărul atomic 7. Azotul elementar este un gaz diatomic incolor, inodor, insipid și mai ales inert în condiții standard, constituind 78,09% din atmosfera Pământului în volum., Azotul este un element comun în univers, estimat la aproximativ șapte în abundență totală în galaxia noastră și în sistemul solar. Se crede că apariția sa se datorează în întregime sintezei prin fuziunea carbonului și hidrogenului în supernove. Datorită volatilității azotului elementar și a compușilor săi cu hidrogen și oxigen, azotul este mult mai puțin obișnuit pe planetele stâncoase ale sistemului solar interior și este un element relativ rar pe Pământ. Cu toate acestea, ca și pe Pământ, azotul și compușii săi apar frecvent ca gaze în atmosferele planetelor și lunilor.,azotul apare în toate organismele vii, în principal în aminoacizii care alcătuiesc proteinele și acizii nucleici (ADN și ARN). Corpul uman este de aproximativ trei procente de azot în greutate, al patrulea element cel mai abundent după oxigen, carbon și hidrogen. Azotul se află în structura chimică a aproape tuturor neurotransmițătorilor și este o componentă definitorie a alcaloizilor, molecule biologice produse ca metaboliți secundari de multe organisme.,ciclul azotului descrie mișcarea elementului din aer în biosferă și compuși organici și înapoi în atmosferă. Nitrații produși sintetic sunt ingrediente cheie ale îngrășămintelor industriale și poluanților cheie care cauzează eutrofizarea sistemelor de apă.
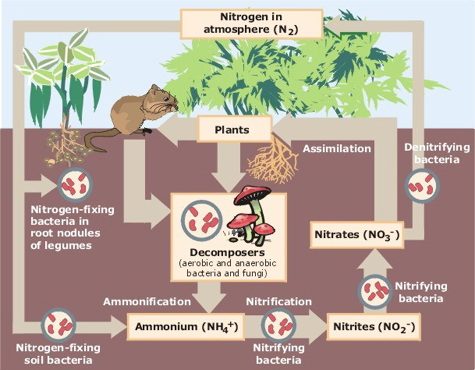
Azot CycleThe figura rezumă cele mai importante procese prin care azotul este convertit între diferitele sale forme pe suprafața pământului., Producția Industrială de Azot
Azot este un gaz industrial produs de distilare fracționată de aer lichid sau prin mijloace mecanice, folosind gazos de aer (de exemplu, sub presiune, membrana de osmoza inversa sau pressure swing adsorption). Azotul comercial este adesea un produs secundar al procesării aerului pentru concentrația industrială de oxigen pentru fabricarea oțelului și în alte scopuri. Atunci când este furnizat comprimat în cilindri, este adesea numit OFN (azot fără oxigen).,
Într-un laborator chimic se prepară prin tratarea unei soluții apoase de clorură de amoniu cu nitrit de sodiu, sau prin descompunerea azidă de sodiu:
NH_4Cl (aq) + NaNO_2 (aq) \rightarrow N_2 (g) + NaCl (aq) + 2 H_2O (l)2 NaN_3 \rightarrow 2 Na + 3 N_2
Proprietăți Chimice de Azot
Azotul este un nemetal cu o electronegativitate de 3.04. Are cinci electroni în învelișul său exterior și este, prin urmare, trivalent în majoritatea compușilor. Legătura triplă în azot molecular (N2) este una dintre cele mai puternice cunoscute., Dificultatea rezultată a transformării N2 în alți compuși și ușurința (și eliberarea de energie ridicată asociată) de transformare a compușilor de azot în N2 elementar, au dominat rolul azotului atât în natură, cât și în activitățile economice umane.azotul Molecular (14n2) este în mare măsură transparent pentru radiațiile infraroșii și vizibile, deoarece este o moleculă homonucleară și, prin urmare, nu are un moment dipol pentru a cupla radiația electromagnetică la aceste lungimi de undă., Absorbția semnificativă are loc la lungimi de undă ultraviolete extreme, începând cu o lungime de undă de aproximativ 100 nanometri. Acest lucru este asociat cu tranzițiile electronice din moleculă către stări în care încărcarea nu este distribuită uniform între atomii de azot. Absorbția azotului duce la absorbția semnificativă a radiațiilor ultraviolete în atmosfera superioară a Pământului și în atmosferele altor corpuri planetare.

Spectrul de NitrogenSending un curent electric prin azot excita electronii la niveluri mai ridicate de energie., Când acestea cad la niveluri mai scăzute de energie, se observă anumite frecvențe ale luminii (pe baza diferenței de energie a nivelurilor de energie), așa cum se arată.,de ambalat sau vrac, produse alimentare - În ordinare becuri cu incandescență, ca o alternativă ieftină la argon
- În producția de componente electronice precum tranzistori, diode și circuite integrate
- de Umplere auto și anvelope de aeronave, datorită inerției și a lipsei de umiditate sau calități oxidative, comparativ cu aer
- Ca un combustibil pentru proiect vin, și ca o alternativă la sau în combinație cu dioxid de carbon în băuturi carbogazoase
de Azot este, de asemenea, utilizat în prepararea probelor pentru analiza chimică să se concentreze și de a reduce volumul de lichid probe., Direcționarea unui flux presurizat de azot gazos perpendicular pe suprafața lichidului permite solventului să se evapore, lăsând în urmă solventul(soluții) și solventul neevaporat. Rezervoarele de azot înlocuiesc, de asemenea, dioxidul de carbon ca sursă principală de energie pentru armele de paintball. Dar, azotul trebuie menținut la o presiune mai mare decât CO2, ceea ce face ca rezervoarele N2 să fie mai grele și mai scumpe.
Lasă un răspuns