presiune și KMT
fenomenele macroscopice ale presiunii pot fi explicate în termeni de teoria moleculară cinetică a gazelor. Să presupunem cazul în care o moleculă de gaz (reprezentată de o sferă) se află într-o cutie, lungimea L (Figura 1). Folosind ipotezele expuse mai sus și considerând că sfera se mișcă doar în direcția x, putem examina instanța sferei care se ciocnește elastic cu unul dintre pereții cutiei.,
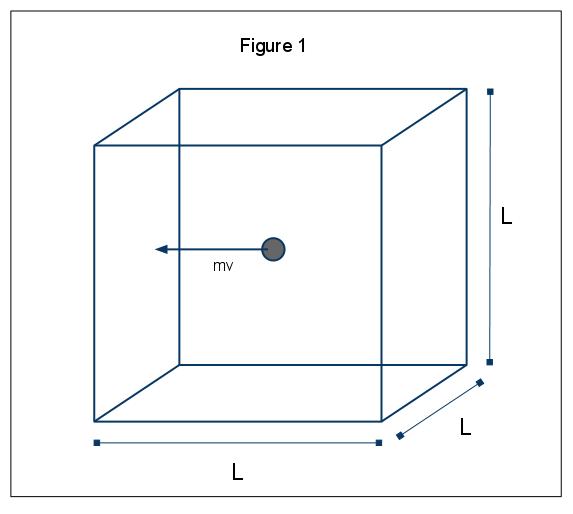
impulsul de această coliziune este dată de p=mv, în acest caz p=mvx, din moment ce sunt doar având în vedere dimensiunea x. Schimbarea totală a impulsului pentru această coliziune este apoi dată de
\
având în vedere că timpul necesar între coliziunile moleculei cu peretele este L/vx putem da frecvența coliziunilor moleculei împotriva unui perete dat al cutiei pe unitatea de timp ca vx/2L., Se poate rezolva acum pentru schimbarea impulsului pe unitatea de timp:
\
rezolvarea pentru impuls pe unitatea de timp dă forța exercitată de un obiect (F=ma=p/time)., Cu expresia asta F=mvx2/L se poate rezolva acum pentru presiunea exercitată de către moleculară coliziune, în cazul în care zona este dat ca zona de un perete din cutie, O=L2:
\
\
expresia poate fi acum scrise în termeni de presiune asociate cu coliziuni de numărul N de molecule:
\
Această expresie poate fi acum ajustat la contul de circulație în x, y și z direcții prin utilizarea medie pătratică a vitezei pentru trei dimensiuni și o mare valoare de N., Expresia acum este scrisă ca:
\
această expresie dă acum presiune, o calitate macroscopică, în ceea ce privește mișcarea atomică. Semnificația relației de mai sus este că presiunea este proporțională cu viteza medie-pătrată a moleculelor dintr-un recipient dat. Prin urmare, pe măsură ce viteza moleculară crește, la fel și presiunea exercitată asupra recipientului.
Lasă un răspuns