karbonylgruppen
c=O är benägen för tillägg och nukleofillisk attack eftersom eller kols positiva laddning och syres negativa laddning. Resonansen av kolet partiell positiv laddning tillåter den negativa laddningen på nukleofilen att attackera karbonylgruppen och bli en del av strukturen och en positiv laddning (vanligtvis ett protonväte) attackerar syret., Bara en påminnelse, nukleofilen är en bra syra, därför ”gillar protoner” så det kommer att attackera sidan med en positiv laddning.
innan vi i detalj överväger reaktiviteten hos aldehyder och ketoner måste vi se tillbaka och påminna oss om hur bindningsbilden ser ut i en karbonyl. Karbonylkarboner är sp2 hybridiserade, med de tre SP2-orbitalerna som bildar soverlaps med orbitaler på syret och på de två kol-eller väteatomerna. Dessa tre obligationer anta trigonal plan geometri., Den återstående unhybridized 2P orbital på den centrala karbonyl kol är vinkelrät mot detta plan, och bildar en ”sida vid sida” pbond med en 2P orbital på syret.
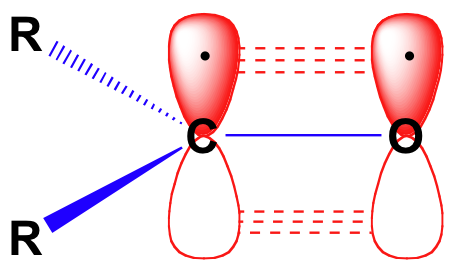
kol-syre dubbelbindningen är polär: syre är mer elektronegativ än kol, så elektrondensiteten är högre på syresidan av bindningen och lägre på kolsidan. Minns att bond polaritet kan avbildas med en dipol pil, eller genom att visa syret som håller en partiell negativ laddning och karbonylkol en partiell positiv laddning.,

ett tredje sätt att illustrera kolsyredipol är att överväga de två huvudsakliga resonansbidragarna i en karbonylgrupp: den huvudsakliga formen, vilket är vad du vanligtvis ser dras i Lewis strukturer, och en mindre men mycket viktig bidragsgivare där båda elektronerna i pbonden är lokaliserade på syret, vilket ger den en fullständig negativ laddning. Den senare skildringen visar kolet med en tom 2P orbital och en full positiv laddning.
Lämna ett svar