en undernivå är en energinivå som definieras av quantum theory.In Kemi, undernivåer hänvisar till energier associerade med electrons.In fysik, undernivåer kan också hänvisa till energier associerade med kärnan.,
Niels Bohrs tidigaste kvantteori sade att elektroner upptar sfäriska skal centrerade på atomkärnan, såsom de två elektronskal som visas för litium nedan:
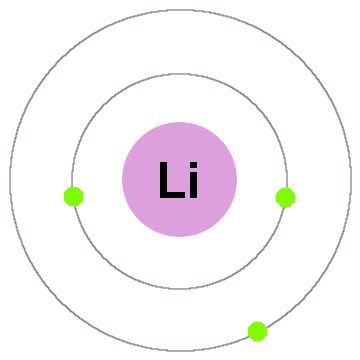
i denna gamla skalmodell rör sig utåt:
- Shell 1 kan hålla upp till 2 elektroner,
- Shell 2 kan hålla upp till 8 elektroner,
- Shell 3 kan hålla upp till 18 elektroner,
lektroner,
- Shell 4 kan hålla upp till 32 elektroner,
- Shell 5 kan hålla upp till 50 elektroner,…
varje skal är faktiskt en energinivå., Ju högre skalet desto högre är energin hos dess elektron(er). Alla elektroner som delar ett skal är degenererade, vilket innebär att de har samma mängd energi.
framsteg i spektroskopi avslöjade att skal faktiskt kan innehålla subshells / sublevels.Elektronerna i shell 3 kan till exempel ha olika mängder energi från varandra eftersom de upptar olika undernivåer.
energinivådiagrammet nedan visar undernivåer så högt som energinivån i 5F-orbitalerna.,Undernivåer fortsätter faktiskt att högre energier än detta, men 5f är en lämplig plats att lämna en inledande beskrivning.
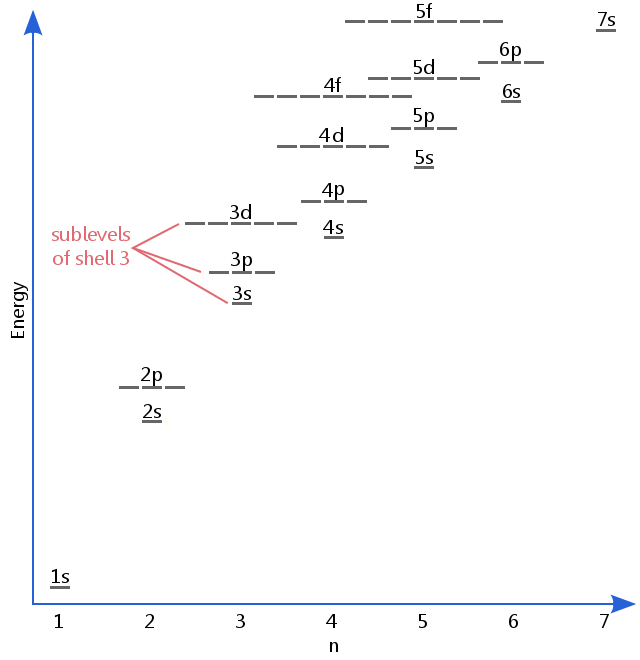

elektronundernivåer är kända med bokstäverna S, P, D och f.So till exempel har elektroner i s-undernivån av shell 3 en annan mängd energi från elektroner i P-och D-nivåerna av shell 3.(Så är inte fallet för väte., Alla vätenivåer har samma energi, eftersom väte bara har en elektron.)
S, P, d och f undernivåer
undernivån som upptas av någon elektron bestäms av elektronens vinkelmoment kvantnummer, l.,div id=”7de4153d3c”>
The energy level diagram excerpt below shows the sublevels corresponding to different values of l in the fourth electron shell.,
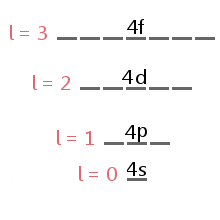
undernivå orbitaler har karakteristiska former som kan användas för att förklara och förutsäga de kemiska bindningar som atomer kan bilda.Dessa former är baserade på sannolikheten för att hitta en elektron på någon särskild plats som kretsar kring kärnan.
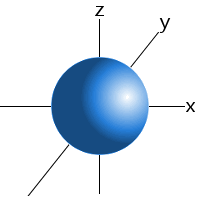
till exempel kan vi säga att en elektron i en väteatoms 1s-undernivå kommer att hittas 99 procent av tiden någonstans i en sfär med en given radie runt kärnan.Detta är anledningen till att vi kan rita s sublevels orbitaler som en sfär.,
orbitaler för högre undernivåer dras också på grundval av var en atoms elektroner sannolikt kommer att hittas. Se orbitaler för mer information.
an s sublevels orbital
Sublevel exempel
exempel på de undernivåer som finns i olika atomer visas nedan. Upphöjningen visar antalet elektroner i varje undernivå.
väte: 1s1
kol: 1S2 2s2 2P2
klor: 1S2 2S2 2P6 3S2 3P5
Argon: 1S2 2s2 2p6 3s2 3P6
i allmänhet går elektroner in i lägsta tillgängliga energiundernivå., Den allmänna ordningen i vilken undernivåer fylls är:
1s 2s 2P 3s 3P 4S 3d 4P 5s 4D 5p 6s 4F 5D 6p 7s 5F 6d 7p
Med tanke på detta kan vi svara på frågor som: ”Vad är kaliums elektronnivåer?”
kalium har 19 elektroner, och vi vet att s orbitaler håller högst två elektroner och p högst sex. Kaliums elektronundernivåer kommer att vara:
Lämna ett svar