tryck och KMT
de makroskopiska fenomenen av tryck kan förklaras i termer av den kinetiska molekylära teorin för gaser. Antag det fall där en gasmolekyl (representerad av en sfär) finns i en låda, längd L (figur 1). Genom att använda de antaganden som anges ovan, och med tanke på att sfären bara rör sig i x-riktningen, kan vi undersöka förekomsten av sfären som kolliderar elastiskt med en av lådans väggar.,
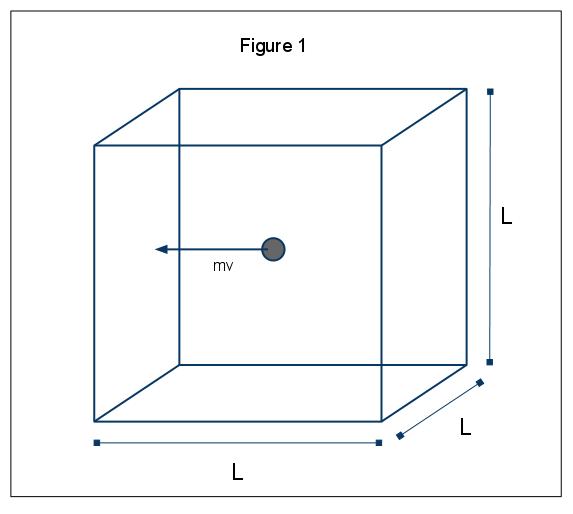
kraften i denna kollision ges av p=MV, i detta fall p=mvx, eftersom vi bara överväger X-dimensionen. Den totala momentumförändringen för denna kollision ges sedan av
\
Med tanke på att den tid det tar mellan kollisioner av molekylen med väggen är L/vx kan vi ge frekvensen av kollisioner av molekylen mot en given vägg av lådan per tidsenhet som VX/2L., Man kan nu lösa för förändringen i momentum per tidsenhet:
\
att lösa för momentum per tidsenhet ger kraften som utövas av ett objekt (F=ma=p/tid)., Med uttrycket att f=mvx2/l man nu kan lösa för det tryck som utövas av den molekylära kollisionen, där området ges som området för en vägg av lådan, A=L2:
\
\
uttrycket kan nu skrivas i termer av trycket i samband med kollisioner från N antal molekyler:
\
detta uttryck kan nu justeras för att redogöra för rörelse i X -, y-och z-riktningarna genom att använda medelkvadratidshastighet för tre dimensioner och ett stort värde på N., Uttrycket är nu skrivet som:
\
detta uttryck ger nu Tryck, en makroskopisk kvalitet, när det gäller atomrörelse. Betydelsen av ovanstående förhållande är att trycket är proportionellt mot molekylernas medelkorgshastighet i en given Behållare. Därför, som molekylhastigheten ökar så gör trycket utövas på behållaren.
Lämna ett svar