Metoximetan har samma molekylformel, samma antal elektroner och ungefär samma form och storlek som etanol. Trots dessa likheter är de strukturella formlerna (organisationen av de enskilda molekylerna i rymden) olika mellan etanol (CH3CH2OH) och metoximetan (CH3OCH3). Denna skillnad i konfigurationen av atomer inom molekylerna har en dramatisk effekt på volatiliteten hos etanol jämfört med metoximetan.,
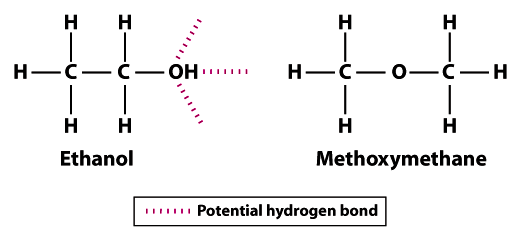 strukturerna visar varför etanol är mindre flyktig än metoximetan; etanol kan bilda tre vätebindningar och metoximetan kan inte bilda någon.Observera att väteatomerna i metoximetan inte kan delta i vätebindning med närliggande syreatomer. Hydroxylgruppens väteatom (OH) i etanol ökar potentialen för vätebindning mellan närliggande etanolmolekyler. Jämfört med metoximetan är etanol inte alls lika flyktigt. Kokpunkten för 78,5 ° C för etanol är signifikant högre jämfört med -24.,8 ° C för metoximetan. Detta exempel illustrerar betydelsen av bindningsstyrka i allmänhet och vätebindning specifikt som en determinant av volatilitet hos en molekyl.
strukturerna visar varför etanol är mindre flyktig än metoximetan; etanol kan bilda tre vätebindningar och metoximetan kan inte bilda någon.Observera att väteatomerna i metoximetan inte kan delta i vätebindning med närliggande syreatomer. Hydroxylgruppens väteatom (OH) i etanol ökar potentialen för vätebindning mellan närliggande etanolmolekyler. Jämfört med metoximetan är etanol inte alls lika flyktigt. Kokpunkten för 78,5 ° C för etanol är signifikant högre jämfört med -24.,8 ° C för metoximetan. Detta exempel illustrerar betydelsen av bindningsstyrka i allmänhet och vätebindning specifikt som en determinant av volatilitet hos en molekyl.
Lämna ett svar