inte långt efter att G. N. Lewis populariserade elektron dot-modellen blev kvantmekanik en mycket kraftfull modell, inklusive dess användning för att beskriva den kemiska bindningen. Två modeller–valence bond-modellen och molekylär orbital-modellen — utvecklades nästan samtidigt. Linus Pauling blev mästare i valence bond-modellen, vilket är lättare att visualisera och använda. Denna modell är i huvudsak en kvantmekanisk version av elektronpunktsmodellen: den försöker beskriva vilka orbitaler som används av varje atom när elektroner delas., Till exempel, när den enkla molekylen H2 bildas från väteatomer, säger valensbindningsmodellen att en s-orbital på en atom överlappar med en s-orbital på den andra för att bilda en bindning. Detta avbildas ibland av ett överlappningsdiagram och en bild som visas i figur 30.

figur 30. Överlappningsdiagram och bild för valensbandet beskrivning av diatomiskt väte.,
ett av de problem som Pauling stött på tidigt i sin banbrytande ansträngningar med valence bond teori är tydligt exemplifieras av en enkel valence bond bild av bindningen i vatten. Figur 31 visar två p-orbitaler på syre som överlappar med s-orbitaler på hydrogener. Denna bild visar tydligt att bindningsvinkeln i vatten ska vara 90° , eftersom de två p-orbitalerna är inriktade längs X-och y-axlarna och därför är vinkelräta.

figur 31. Orbital överlappning i vatten.,
faktum är att bindningsvinkeln i vatten är 105°, en signifikant avvikelse från 90°. Denna typ av fel kanske inte verkar betydande för dig, men för någon som försöker formulera en modell som kommer att förklara så mycket av en viss del av naturen som möjligt, är denna skillnad mellan teori och experimentell faktum mycket besvärlig. Pauling lade sedan till en annan ändring i teorin — hybridisering., Pauling sa att atomiska orbitaler på en atom inte är heliga, de är bara en möjlig uppsättning matematiska ekvationer (kom ihåg vår diskussion om vågmodellen) som kan användas för att beskriva elektronerna i den atomen. Andra uppsättningar kan genereras genom att lägga till och subtrahera dessa atomiska orbitaler enligt vissa regler. Således, om en s orbital och de tre p-orbitalerna kombineras matematiskt, genereras en ny uppsättning orbitaler, sp3 orbitaler. Den nya uppsättningen orbitaler har olika orienteringsegenskaper än uppsättningen atomära orbitaler., Figur 32 visar s och tre p-orbitaler i del a och sedan i del b de fyra nya SP3-hybriderna. Som du kan se är dessa sp3-hybrider orienterade mot hörnen av en tetraeder. Figur 33 visar att dessa hybrider används för att beskriva bindningen i vatten. Eftersom vinkeln mellan hybriderna är 109°, förväntar vi oss nu att bindningsvinkeln i vatten är 109°. Det är uppenbart att detta ger oss en bättre överenskommelse med det experimentella värdet på 105°. (Observera att detta inte är i perfekt överenskommelse, men det är det bästa vi kan göra.,) Andra hybridiseringskombinationer är också möjliga, och dessa sammanfattas i Figur 34.

figur 32. SP3 hybridisering.
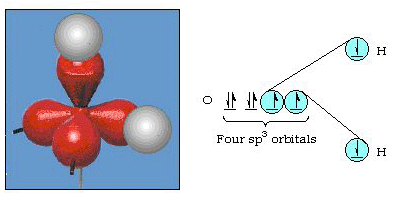
figur 33. Användning av SP3 hybrider för att förklara bindningsvinkeln i vatten.
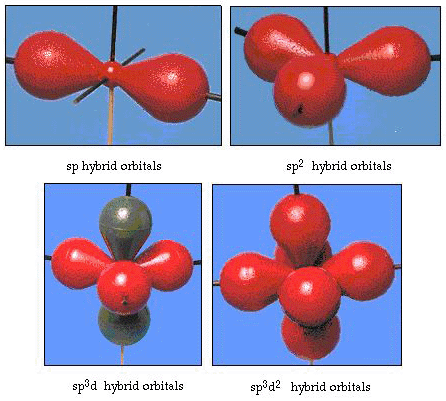
figur 34. Andra hybridiseringssystem.
tryck på för video
det finns en annan funktion i valence bond-modellen som förtjänar diskussion. Det illustreras fint av vår välbekanta syremolekyl, O2., Figur 35 visar överlappningen av två px-orbitaler för att ge oss ett enda band. Om vi ska lyda oktettregeln måste vi också bilda ett annat band. Detta måste vara genom överlappning av två Py eller två PZ orbitaler (det spelar ingen roll vilken). Denna bindning har sin elektrondensitet över och under den inre kärnlinjen, snarare än direkt mellan de två syrekärnorna. Denna bindning kallas en 1-bindning, medan den som sätter elektrondensitet mellan atomerna kallas en sigma (σ) bindning., En av de intressanta konsekvenserna av denna bild är att 1-bindningen förväntas vara svagare än sigma-bindningen (överlappningen av orbitalerna är svagare). Detta innebär att en dubbelbindning inte har styrkan av två enkelbindningar och är också mer mottagliga för angrepp av yttre atomer som söker efter elektrondensitet.

figur 35. Bildning av sigma och pi-bindningar i diatomiskt syre.,
som ett sista exempel på valensbindningsbehandlingen av bindning visar figur 36 en bild av de orbitaler som är involverade i bindningen i eten, det enklaste omättade kolvätet (H2C=CH2). Experimentellt har det visat sig att bindningsvinklarna runt varje kol är nästan 120°. Således visar vår bild användningen av SP2-hybrider (eftersom de har 120° vinklar mellan varandra) för byggandet av sigma-bindningar. 1-bindningen bildas genom överlappning av två PZ-orbitaler. Det är viktigt att märka att 1-bindningen introducerar ett rotationshinder om kol-kolförbindelsen., Det vill säga, om en CH2-grupp skulle rotera, skulle 1-bindningen behöva brytas, vilket skulle kräva stor energi. Konsekvensen av detta är att 1-bond fixar de två CH2-grupperna i ett plan, vilket gör att den totala molekylen är plan.

figur 36. Bindningen i eten.
den molekylära orbitalmodellen har ett annat tillvägagångssätt. Det använder alla orbitaler på alla atomer för att generera en uppsättning orbitaler som sträcker sig över alla atomer på hela molekylen., Den molekylära orbitalmodellen är svårare att visualisera, men den är också kraftfullare. Den svåra processen att bestämma hur man kombinerar atomobitaler för att generera molekylära orbitaler görs nu av dator för även stora molekyler. Den praktiserande kemisten använder molekylär orbitalmodellen för att förutsäga spektra, övergångstillstånd etc., men för vardagliga kemiska diskussioner, elektron dot och valence bond modeller fortfarande styra dagen.
Lämna ett svar