frysepunktssænkning
frysepunktet af et stof er den temperatur, hvor den faste og flydende former kan eksistere side om side på ubestemt tid — det er, de er i ligevægt. Under disse forhold passerer molekyler mellem de to faser i lige store mængder, fordi deres flugtende tendenser fra de to faser er identiske., Antag, at et flydende opløsningsmiddel og dets faste (vand og is, for eksempel) er i ligevægt (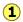 nedenfor), og vi tilføjer et ikke-flygtigt opløst stof (såsom salt, sukker eller frostvæske til bilindustrien) til vandet. Dette vil have den virkning at reducere molfraktionen af H2O-molekyler i væskefasen og således reducere disse molekylers tendens til at flygte fra den, ikke kun ind i dampfasen (som vi så ovenfor), men også ind i den faste (is) fase., Dette vil ikke have nogen indflydelse på den hastighed, hvormed H2O-molekyler slipper ud af isen i vandfasen, så systemet ikke længere vil være i ligevægt, og isen vil begynde at smelte
nedenfor), og vi tilføjer et ikke-flygtigt opløst stof (såsom salt, sukker eller frostvæske til bilindustrien) til vandet. Dette vil have den virkning at reducere molfraktionen af H2O-molekyler i væskefasen og således reducere disse molekylers tendens til at flygte fra den, ikke kun ind i dampfasen (som vi så ovenfor), men også ind i den faste (is) fase., Dette vil ikke have nogen indflydelse på den hastighed, hvormed H2O-molekyler slipper ud af isen i vandfasen, så systemet ikke længere vil være i ligevægt, og isen vil begynde at smelte .
.

Hvis vi ønsker at forhindre, at det faste stof smelter, skal molekylernes flugtende tendens fra det faste stof reduceres., Dette kan opnås ved at reducere temperaturen; dette sænker flygter tendens af molekyler fra begge faser, men det påvirker dem i den mere solid end dem, der er i væsken, så vi i sidste ende nå frem til den nye, lavere frysepunkt, hvor de to mængder er igen i præcis balance og begge faser kan sameksistere  .
.
Hvis du foretrækker at tænke med hensyn til damptryk, kan du bruge det samme argument, hvis du husker, at damptrykket fra det faste stof og væsken skal være det samme ved frysepunktet., Fortynding af væsken (opløsningsmidlet) med det ikke-flygtige opløste stof reducerer opløsningsmidlets damptryk i henhold til Raoults lov, hvilket reducerer temperaturen, ved hvilken damptrykket i de flydende og frosne former af opløsningen vil være ens. Som med kogepunktshøjde er der i fortyndede opløsninger en simpel lineær relation mellem frysepunktsdepression og molaliteten af det opløste stof:
\
Bemærk, at Kf-værdier alle er negative!
Saltveje
brugen af salt til afisningsveje er en almindelig anvendelse af dette princip., Den opløsning, der dannes, når noget af saltet opløses i den fugtige is, reducerer isens frysepunkt. Hvis frysepunktet falder under omgivelsestemperaturen, smelter isen. I meget koldt vejr kan omgivelsestemperaturen være under saltopløsningen, og saltet har ingen virkning.,d=”3d8b2121c5″>
CaCl2
Automotive radiator antifreezes are mostly based on ethylene glycol, (CH2OH)2., På grund af denne dobbelte alkohols stærke hydrogenbindende egenskaber er dette stof blandbart med vand i alle forhold og bidrager kun med et meget lille damptryk. Udover at sænke frysepunktet hæver frostvæske også kogepunktet, hvilket øger kølesystemets driftsområde. Den rene glykol fryser ved -12, 9.C og koger ved 197. C, hvilket gør det muligt at skræddersy vand-glykol-blandinger til en lang række forhold.,
eksempel \(\Pageinde. {2}\)
estimere frysepunktet for en frostvæskeblanding består ved at kombinere et volumen ethylenglycol (M. = 62, densitet 1,11 g cm–3) med to volumener vand.
opløsning
Antag, at vi bruger 1 L glycol og 2 L vand (de faktiske volumener betyder ikke noget, så længe deres forhold er som angivet.) Massen af glycol vil være 1.10 kg, og at vandet vil være 2,0 kg, så den samlede masse af løsningen er 3.11 kg. Vi har derefter:
- antal mol glycol: (1110 g) ((62 g mol–1) = 17.,9 mol
- molality af glykol: (17.9 mol) ÷ (2,00 kg) = 8.95 mol kg–1
- frysepunktssænkning: ΔTF = (-1.86 kg K–1 mol) × (8.95 mol kg–1) = -16.6 K, så den løsning vil fryse til om -17°C.
Enhver ioniske arter dannes ved dissociation vil også bidrage til frysepunktssænkning. Dette kan tjene som et nyttigt middel til at bestemme fraktionen af et opløst stof, der er dissocieret.
Skriv et svar