Science > Kemi > Løsninger og Deres Kolligative Egenskaber > Short-cut Metoder Til Beregning af Koncentrationen af Løsninger
I denne artikel, vi skal studere short-cut metoder til at beregne molality, molaritet, osv.
disse metoder kan kun bruges i konkurrencedygtige eksamener.,
Direkte Formler til at Beregne Molality og Molaritet:

Hvor M = molariteten i mol L-1 eller M
m = molality i mol kg-1 eller m
en = % af massen af opløst stof
d = densitet af løsning i g/mL eller g cm-3.,
MB = Molekylmasse af opløst stof i gram
MA = molekylmasse af opløsningsmiddel i gram
Bemærk: Når du bruger disse formler, skal du sørge for, at mængderne er i foreskrevne enheder
molekylmasser af visse stoffer i gram:
numeriske problemer med at beregne molalitet og molaritet:
eksempel – 01:
densiteten af en opløsning indeholdende 13 vægtprocent svovlsyre er 1,09 g/ml. Beregn molaritet og normalitet af opløsningen
givet: a = 13, D = 1, 09 g/mL
for at finde: molaritet (m) =? og normalitet (n)=?,
Løsning:
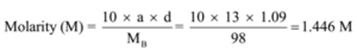
n = Molekylær masse/tilsvarende masse = 98 g/49 g = 2
Normalitet = molariteten x n = 1.446 x 2 = 2.892 N
Eksempel – 02:
tætheden af 2.03 M opløsning af eddikesyre (molekylvægt = 60) i vand er 1.017 g/mL. Beregn molalitet af opløsning
givet: m = 2.03, MB = 60 g mol-1, d = 1.017 g/mL
for at finde: molalitet (m) = ?,
Løsning:

molality = m = 1/0.4410 = 2.268 molal
Eksempel – 03:
tætheden af 10,0% udtrykt i masse af KCl opløsning i vand 1,06 g/mL. Beregn molalitet, molaritet og molfraktion af KCl.
givet: a = 10, d = 1, 06 g/mL
for at finde: molaritet (m) =?, molalitet (m) =?, molfraktion (=b)=?
Løsning:

Ans: Molariteten 1.,42 M, Molality = 1.491 m, Mole fraction = 0.0261
Example – 04:
0.8 M solution of H2SO4 has a density of 1.06 g/cm3. calculate molality and mole fraction
Given: M = 0.8 M, d = 1.06 g/cm3.
To Find: Molality (m) =?, mole fraction (XB) =?
Solution:

molality = m = 1/1.227 = 0.814 molal

0.814 x 18 x (1 – XB) = 1000 XB
14.,652 – 14.652 XB = 1000 XB
1014.652 XB = 14.652
XB = 14.652/1014.652 = 0.014
Eksempel – 05:
En 6,90 M opløsning af KOH-i vand, der indeholder 30% af massen af KOH. Beregn opløsningens densitet.
givet: m = 6,90 m, a = 30
for at finde: opløsningens massefylde = d = ?
Løsning:

Ans: Tæthed af løsning = 1.288 g/mL
Eksempel – 06:
i Betragtning: a = 10, d = 1.070 g cm-3,
for At Finde ud af: molbrøk =? molaritet = ?, and molality =?
Solution:

Example – 07:
Calculate the mole fraction of solute in its 2 molal aqueous solution.
Given: molality = 2 molal
To Find: Mole fraction =?,
Solution:

Previous Topic: Numerical Problems on Molality
Next Topic: Solutions of Gases in Liquids
Skriv et svar