Science > Chemistry > Solutions and Their Colligative Properties > Short-Cut-Methoden zur Berechnung der Konzentration von Lösungen
In diesem Artikel werden wir Kurzschnittmethoden zur Berechnung von Molalität, Molarität usw. untersuchen.
Diese Methoden können nur in Wettbewerbsprüfungen verwendet werden.,
Direkte Formeln zur Berechnung von Molalität und Molarität:

Wobei M = Molarität in mol L-1 oder M
m = Molalität in Mol kg-1 oder m
a = % durch masse des gelösten Stoffes
d = Dichte der Lösung in g/ml oder g cm-3.,
MB = Molekulare Masse des gelösten Stoffes in Gramm
MA = Molekulare Masse des Lösungsmittels in Gramm
Hinweis: Achten Sie bei der Verwendung dieser Formeln darauf, dass die Mengen in vorgeschriebenen Einheiten liegen
Molekulare Massen bestimmter Stoffe in Gramm:
Numerische Probleme zur Berechnung von Molalität und Molarität:
Beispiel – 01:
Die Dichte einer Lösung mit 13 Massenprozent Schwefelsäure beträgt 1,09 g/ml. Berechnen Sie Molarität und Normalität der Lösung
Gegeben: a = 13, d = 1.09 g/mL
Zu Finden: Molarität (M) =? und Normalität (N) =?,
Lösung:
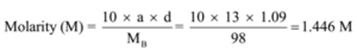
n = Molekulare Masse/äquivalente Masse = 98 g/49 g = 2
Normalität = Molarität x n = 1.446 x 2 = 2.892 N
Beispiel – 02:
Die Dichte von 2,03 M Essigsäurelösung (Molekularmasse = 60) in Wasser beträgt 1,017 g/ml. Berechnen molalität der Lösung
Gegeben: M = 2.03, MB = 60 g mol-1, d = 1.017 g/mL
Zu Finden: Molalität (m) = ?,
Lösung:

molalität = m = 1/0.4410 = 2.268 molal
Beispiel – 03:
Die Dichte von 10,0 gew. – % der KCl-Lösung in Wasser ist 1,06 g/mL. Berechnen Sie die Molalität, Molarität und Molfraktion von KCl.
Gegeben: a = 10, d = 1.06 g/mL
Zu Finden: Molarität (M) =?, molalität (m) =?, Molfraktion (XB) =?
Lösung:

Ans: Molarität 1.,42 M, Molality = 1.491 m, Mole fraction = 0.0261
Example – 04:
0.8 M solution of H2SO4 has a density of 1.06 g/cm3. calculate molality and mole fraction
Given: M = 0.8 M, d = 1.06 g/cm3.
To Find: Molality (m) =?, mole fraction (XB) =?
Solution:

molality = m = 1/1.227 = 0.814 molal

0.814 x 18 x (1 – XB) = 1000 XB
14.,652 – 14.652 XB = XB 1000
1014.652 XB = 14.652
XB = 14.652/1014.652 = 0.014
Beispiel – 05:
Eine 6.90 M Lösung von KOH in Wasser enthält 30% durch Masse von KOH. Berechnen Sie die Dichte der Lösung.
Gegeben: M = 6,90 M, a = 30
Zu finden: Lösungsdichte = d = ?
Lösung:

Ans: Dichte der Lösung = 1.288 g/mL
Beispiel – 06:
Gegeben: a = 10, d = 1.070 g cm-3,
Zu Finden: mole fraction =? Molarität = ?, and molality =?
Solution:

Example – 07:
Calculate the mole fraction of solute in its 2 molal aqueous solution.
Given: molality = 2 molal
To Find: Mole fraction =?,
Solution:

Previous Topic: Numerical Problems on Molality
Next Topic: Solutions of Gases in Liquids
Schreibe einen Kommentar