Eine Unterebene ist ein durch Quantum definiertes Energieniveau theory.In chemie, Unterebenen beziehen sich auf Energien, die mit electrons.In physik, Unterebenen können sich auch auf Energien beziehen, die mit dem Kern verbunden sind.,
Niels Bohrs früheste Quantentheorie besagt, dass Elektronen sphärische Schalen besetzen, die auf dem Atomkern zentriert sind, wie die beiden unten gezeigten Elektronenschalen für Lithium:
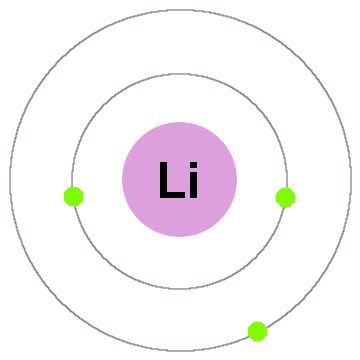
In diesem alten Shell-Modell, das sich nach außen bewegt:
- Shell 1 kann bis zu 2 Elektronen aufnehmen,
- Shell 2 kann bis zu 8 Elektronen aufnehmen,
- Shell 3 kann bis zu 18 Elektronen aufnehmen.,
- Shell 4 kann halten bis zu 32 elektronen,
- Shell 5 kann halten bis zu 50 elektronen,…
Jede Schale ist eigentlich ein Energieniveau., Je höher die Schale, desto höher die Energie ihrer Elektronen. Alle Elektronen, die sich eine Schale teilen, sind degeneriert, was bedeutet, dass sie die gleiche Energiemenge haben.
die Fortschritte in der Spektroskopie zeigte, dass die Schalen können tatsächlich enthalten Unterschalen/Unterebenen.Die Elektronen in Schale 3 können beispielsweise unterschiedliche Energiemengen voneinander haben, weil sie unterschiedliche Unterebenen einnehmen.
Das folgende Energieniveau-Diagramm zeigt Unterebenen, die so hoch sind wie das Energieniveau der 5f-Orbitale.,Unterebenen tatsächlich weiterhin höhere Energien als diese, aber 5f ist ein geeigneter Ort, um eine einführende Beschreibung zu verlassen.
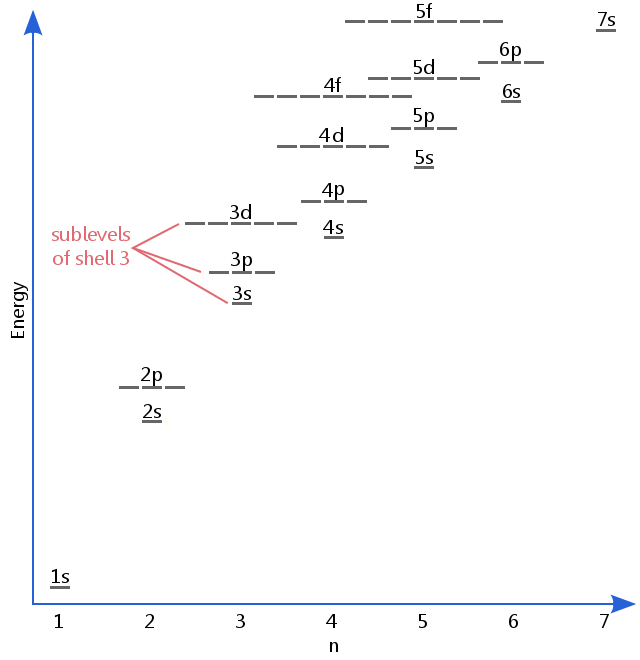

Electron unterebenen sind durch die Buchstaben s, p, d bekannt und f.So Beispielsweise weisen Elektronen in der s-Unterebene der Schale 3 eine andere Energiemenge auf als Elektronen in den p-und d-Ebenen der Schale 3.(Dies ist bei Wasserstoff nicht der Fall., Alle Unterebenen von Wasserstoff haben die gleiche Energie, da Wasserstoff nur ein Elektron hat.)
s, p, d und f Unterebenen
Die von einem Elektron belegte Unterebene wird durch die Quantenzahl des Drehimpulses des Elektrons bestimmt, l.,div id=“7de4153d3c“>
The energy level diagram excerpt below shows the sublevels corresponding to different values of l in the fourth electron shell.,
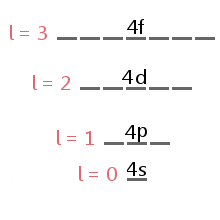
Sublevel orbitale haben charakteristische Formen, dass kann verwendet werden, zu erklären und vorherzusagen, die chemischen Bindungen, die Atome bilden können.Diese Formen basieren auf der Wahrscheinlichkeit, ein Elektron an einem bestimmten Ort zu finden, der den Kern umkreist.
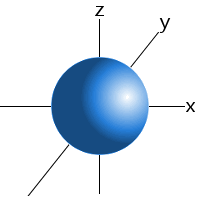
Zum Beispiel können wir sagen, dass ein Elektron in der 1s-Unterebene eines Wasserstoffatoms 99 Prozent der Zeit irgendwo in einer Kugel mit einem bestimmten Radius um den Kern gefunden wird.Dies ist der Grund, warum wir die Orbitale der s-Unterebene als Kugel zeichnen können.,
Orbitale für höhere Unterebenen werden auch auf der Grundlage gezeichnet, wo die Elektronen eines Atoms am wahrscheinlichsten zu finden sind. Siehe Orbitale für weitere Details.
Ein s sublevel ’s orbital
Sublevel Beispiele
Beispiele für die Unterebenen in verschiedenen Atomen sind unten dargestellt. Das hochgestellte zeigt die Anzahl der Elektronen in jeder Unterebene.
Wasserstoff: 1s1
Carbon: 1s2 2s2 2p2
Chlor: 1s2 2s2 2p6 3s2 3p5
Argon: 1s2 2s2 2p6 3s2 3p6
Im Allgemeinen werden die Elektronen gehen in die niedrigste verfügbare Energie Unterstufe., Die Allgemeine Reihenfolge, in der die Unterebenen sind gefüllt wird:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Angesichts dieser, wir können Fragen beantworten wie: „was sind Kalium-s-electron-Unterebenen?“
Kalium hat 19 Elektronen, und wir wissen, dass s-Orbitale maximal zwei Elektronen und p maximal sechs enthalten. Kaliumelektronenunterebenen sind:
Schreibe einen Kommentar