Methoxymethan hat die gleiche molekulare Formel, die gleiche Anzahl von Elektronen und ungefähr die gleiche Form und Größe wie Ethanol. Trotz dieser Ähnlichkeiten unterscheiden sich die Strukturformeln (die Organisation der einzelnen Moleküle im Raum) zwischen Ethanol (CH3CH2OH) und Methoxymethan (CH3OCH3). Dieser Unterschied in der Konfiguration der Atome innerhalb der Moleküle hat einen dramatischen Einfluss auf die Flüchtigkeit von Ethanol gegenüber Methoxymethan.,
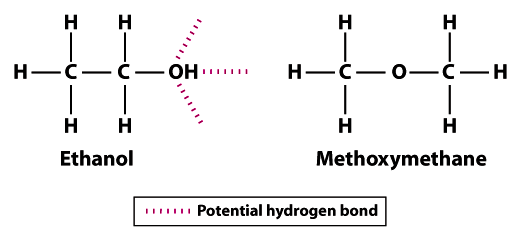 Die Strukturen zeigen, warum Ethanol weniger flüchtig ist als Methoxymethan; Ethanol kann drei Wasserstoffbrücken bilden und Methoxymethan kann keine bilden.Beachten Sie, dass die Wasserstoffatome in Methoxymethan nicht an der Wasserstoffbindung mit benachbarten Sauerstoffatomen teilnehmen können. Das Wasserstoffatom der Hydroxylgruppe (OH) in Ethanol erhöht das Potenzial für eine Wasserstoffbindung zwischen benachbarten Ethanolmolekülen. Im Vergleich zu Methoxymethan ist Ethanol nicht annähernd so flüchtig. Der Siedepunkt von 78,5°C für Ethanol ist im Vergleich zu -24 deutlich höher.,8°C für Methoxymethan. Dieses Beispiel veranschaulicht die Bedeutung der Bindungsstärke im Allgemeinen und der Wasserstoffbindung speziell als Determinante der Volatilität eines Moleküls.
Die Strukturen zeigen, warum Ethanol weniger flüchtig ist als Methoxymethan; Ethanol kann drei Wasserstoffbrücken bilden und Methoxymethan kann keine bilden.Beachten Sie, dass die Wasserstoffatome in Methoxymethan nicht an der Wasserstoffbindung mit benachbarten Sauerstoffatomen teilnehmen können. Das Wasserstoffatom der Hydroxylgruppe (OH) in Ethanol erhöht das Potenzial für eine Wasserstoffbindung zwischen benachbarten Ethanolmolekülen. Im Vergleich zu Methoxymethan ist Ethanol nicht annähernd so flüchtig. Der Siedepunkt von 78,5°C für Ethanol ist im Vergleich zu -24 deutlich höher.,8°C für Methoxymethan. Dieses Beispiel veranschaulicht die Bedeutung der Bindungsstärke im Allgemeinen und der Wasserstoffbindung speziell als Determinante der Volatilität eines Moleküls.
Schreibe einen Kommentar