Lernziel
- Diskutieren Sie die Eigenschaften von Stickstoff.
Schlüsselpunkte
- Stickstoff ist ein chemisches Element mit dem Symbol N und der Ordnungszahl 7. Elementarer Stickstoff ist ein farbloses, geruchloses,geschmackloses und meist inertes zweiatomiges Gas unter Standardbedingungen, das 78,09 Prozent der Erdatmosphäre ausmacht.,
- Stickstoffgas ist ein Industriegas, das durch fraktionierte Destillation flüssiger Luft oder durch mechanische Verwendung gasförmiger Luft erzeugt wird. Kommerzieller Stickstoff ist oft ein Nebenprodukt der Luftverarbeitung für die industrielle Sauerstoffkonzentration.
- Stickstoffgas hat eine Vielzahl von Anwendungen, einschließlich als inerter Ersatz für Luft, wo Oxidation unerwünscht ist. Flüssiger Stickstoff wird auch verwendet, um Objekte kryogen einzufrieren.
- elementalOf, bezogen auf oder ein Element sein (im Gegensatz zu einer Verbindung).,
- Aminosäuregeneral Moleküle, die sowohl eine Amino-als auch eine Carbonsäurefunktionsgruppe enthalten. Die Monomere, aus denen Polypeptidketten oder Proteine aufgebaut sind, sind Aminosäuren.
- nitrogenA chemisches Element (Symbol N) mit einer Ordnungszahl von 7 und einem Atomgewicht von 14.0067 amu.
Das Element Stickstoff wurde 1772 vom schottischen Arzt Daniel Rutherford als trennbarer Bestandteil der Luft entdeckt. Stickstoffverbindungen waren im Mittelalter bekannt. Alchemisten kannten Salpetersäure als Aqua Fortis (starkes Wasser)., Die Mischung aus Salpetersäure und Salzsäure war bekannt als Aqua Regia (königliches Wasser), berühmt für seine Fähigkeit, Gold (den König der Metalle) aufzulösen. Die frühesten militärischen, industriellen und landwirtschaftlichen Anwendungen von Stickstoffverbindungen verwendeten Salpeter (Natriumnitrat oder Kaliumnitrat), vor allem in Schießpulver und später als Dünger.
Stickstoff ist ein chemisches Element mit dem Symbol N und der Ordnungszahl 7. Elementarer Stickstoff ist ein farbloses, geruchloses,geschmackloses und meist inertes zweiatomiges Gas unter Standardbedingungen, das 78,09 Prozent der Erdatmosphäre ausmacht., Stickstoff ist ein häufiges Element im Universum, das in unserer Galaxie und im Sonnensystem auf etwa den siebten Gesamtreichtum geschätzt wird. Es wird angenommen, dass sein Auftreten vollständig auf die Synthese durch Fusion von Kohlenstoff und Wasserstoff in Supernovas zurückzuführen ist. Aufgrund der Flüchtigkeit von elementarem Stickstoff und seinen Verbindungen mit Wasserstoff und Sauerstoff ist Stickstoff auf den felsigen Planeten des inneren Sonnensystems weitaus seltener und ein relativ seltenes Element auf der Erde. Wie auf der Erde treten Stickstoff und seine Verbindungen jedoch häufig als Gase in den Atmosphären von Planeten und Monden auf.,
Stickstoff in lebenden Systemen
Stickstoff kommt in allen lebenden Organismen vor, hauptsächlich in Aminosäuren, aus denen Proteine bestehen, und Nukleinsäuren (DNA und RNA). Der menschliche Körper ist etwa drei Prozent Stickstoff nach Gewicht, das vierthäufigste Element nach Sauerstoff, Kohlenstoff und Wasserstoff. Stickstoff befindet sich in der chemischen Struktur fast aller Neurotransmitter und ist ein definierender Bestandteil von Alkaloiden, biologischen Molekülen, die von vielen Organismen als Sekundärmetaboliten produziert werden.,
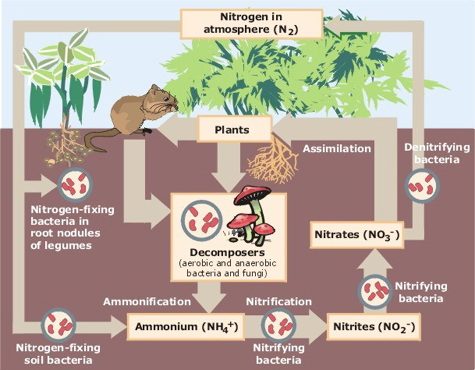
Der Stickstoffkreislauf beschreibt die Bewegung des Elements aus der Luft in die Biosphäre und organische Verbindungen und zurück in die Atmosphäre. Synthetisch hergestellte Nitrate sind wichtige Bestandteile industrieller Düngemittel und wichtige Schadstoffe, die die Eutrophierung von Wassersystemen verursachen.
Industrielle Stickstoffproduktion
Stickstoffgas ist ein Industriegas, das durch fraktionierte Destillation flüssiger Luft oder durch mechanische Verwendung von gasförmiger Luft (d. H. Unter Druck stehende Umkehrosmosemembran oder Druckschwungadsorption) hergestellt wird. Kommerzieller Stickstoff ist oft ein Nebenprodukt der Luftverarbeitung zur industriellen Sauerstoffkonzentration für die Stahlherstellung und andere Zwecke. Wenn es in Zylindern komprimiert geliefert wird, wird es oft OFN (sauerstofffreier Stickstoff) genannt.,
In einem chemischen Labor wird es durch Behandlung einer wässrigen Lösung von Ammoniumchlorid mit Natriumnitrit oder durch Zersetzung von Natriumazid hergestellt:
NH_4Cl (aq) + NaNO_2 (aq) \rightarrow N_2 (g) + NaCl (aq) + 2 H_2O (l)2 NaN_3 \rightarrow 2 Na + 3 N_2
Chemische Eigenschaften von Stickstoff
Stickstoff ist ein Nichtmetall mit einem elektronegativität von 3.04. Es hat fünf Elektronen in seiner äußeren Hülle und ist daher in den meisten Verbindungen dreiwertig. Die Dreifachbindung in molekularem Stickstoff (N2) ist eine der stärksten bekannten., Die daraus resultierende Schwierigkeit, N2 in andere Verbindungen umzuwandeln, und die Leichtigkeit (und damit verbundene hohe Energiefreisetzung) der Umwandlung von Stickstoffverbindungen in elementares N2 haben die Rolle von Stickstoff sowohl in der Natur als auch in menschlichen wirtschaftlichen Aktivitäten dominiert.
Stickstoffemissionsspektrum
Molekularer Stickstoff (14N2) ist für Infrarot-und sichtbare Strahlung weitgehend transparent, da es sich um ein homonukleares Molekül handelt und daher kein Dipolmoment aufweist, um die elektromagnetische Strahlung bei diesen Wellenlängen zu koppeln., Eine signifikante Absorption erfolgt bei extremen ultravioletten Wellenlängen, beginnend bei einer Wellenlänge von etwa 100 Nanometern. Dies ist mit elektronischen Übergängen im Molekül zu Zuständen verbunden, in denen die Ladung nicht gleichmäßig zwischen Stickstoffatomen verteilt ist. Stickstoffabsorption führt zu einer signifikanten Absorption von ultravioletter Strahlung in der oberen Atmosphäre der Erde und in den Atmosphären anderer Planetenkörper.

Stickstoff wird auch in proben für die chemische Analyse vorbereiten, um das Volumen flüssiger Proben zu konzentrieren und zu reduzieren., Wenn ein unter Druck stehender Stickstoffgasstrom senkrecht zur Oberfläche der Flüssigkeit geleitet wird, kann das Lösungsmittel verdampfen, während der gelöste(die) und das nicht evaporierte Lösungsmittel zurückbleiben. Stickstofftanks ersetzen auch Kohlendioxid als Hauptstromquelle für Paintballpistolen. Stickstoff muss jedoch bei höherem Druck als CO2 gehalten werden, wodurch N2-Tanks schwerer und teurer werden.
Schreibe einen Kommentar