Ciencia > química > soluciones y sus propiedades coligativas > métodos de corte corto para calcular la concentración de soluciones
en este artículo, estudiaremos los métodos de corte corto para calcular la molalidad, la molaridad, etc.
estos métodos solo se pueden usar en exámenes competitivos.,
Directo Fórmulas para Calcular la Molalidad y Molaridad:

Donde M = molaridad en mol L-1 o M
m = molalidad de mol kg-1 m
a = % por la masa de soluto
d = densidad de la solución en g/mL o g cm-3.,
MB = masa Molecular del soluto en gramos
MA = masa Molecular del disolvente en gramos
Nota: al utilizar estas fórmulas, tenga cuidado de que las cantidades estén en unidades prescritas
masas moleculares de ciertas sustancias en gramos:
problemas numéricos para calcular Molalidad y molaridad:
Ejemplo – 01:
la densidad de una solución que contiene un 13% en masa de ácido sulfúrico es de 1,09 g/ml. Calcular la molaridad y la normalidad de la solución
Dado: a = 13, d = 1.09 g/mL
Para Encontrar: Molaridad (M) =? y normalidad (N) =?,
Solución:
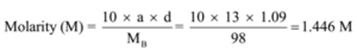
n = masa Molecular/equivalente masa = 98 g/49 g = 2
la Normalidad = molaridad x n = 1.446 x 2 = 2.892 N
Ejemplo – 02:
La densidad de 2,03 M de la solución de ácido acético (masa molecular = 60) en el agua es de 1.017 g/mL. Calcule la molalidad de la solución
dado: M = 2.03, MB = 60 g mol-1, d = 1.017 g/mL
para encontrar: Molalidad (m) = ?,
Solución:

la molalidad = m = 1/0.4410 = 2.268 molal
Ejemplo – 03:
La densidad de 10.0% en masa de la solución de KCl en agua es de 1,06 g/mL. Calcular la molalidad, molaridad y fracción molar de KCl.
Dado: a = 10, d = 1,06 g/mL
Para Encontrar: Molaridad (M) =?, Molalidad (m)=?, fracción molar (XB) =?
Solución:

Ans: Molaridad 1.,42 M, Molality = 1.491 m, Mole fraction = 0.0261
Example – 04:
0.8 M solution of H2SO4 has a density of 1.06 g/cm3. calculate molality and mole fraction
Given: M = 0.8 M, d = 1.06 g/cm3.
To Find: Molality (m) =?, mole fraction (XB) =?
Solution:

molality = m = 1/1.227 = 0.814 molal

0.814 x 18 x (1 – XB) = 1000 XB
14.,652 – 14.652 XB = 1000 XB
1014.652 XB = 14.652
XB = 14.652/1014.652 = 0.014
Ejemplo – 05:
Un 6.90 M solución de KOH en agua que contiene 30% en masa de KOH. Calcular la densidad de la solución.
Dado: M = 6.90 M, a = 30
Para Encontrar: densidad de la solución = d = ?
Solución:

Ans: Densidad de la solución = 1.288 g/mL
Ejemplo – 06:
Dado: a = 10, d = 1.070 g cm-3,
Para Encontrar: fracción molar =? molaridad = ?, and molality =?
Solution:

Example – 07:
Calculate the mole fraction of solute in its 2 molal aqueous solution.
Given: molality = 2 molal
To Find: Mole fraction =?,
Solution:

Previous Topic: Numerical Problems on Molality
Next Topic: Solutions of Gases in Liquids
Deja una respuesta