Tiede > Kemia > Ratkaisut ja Niiden Kolligatiivisten Ominaisuuksien > oikotie laskentamenetelmät Pitoisuus Ratkaisuja
tässä artikkelissa, aiomme tutkia oikotie menetelmiä laskea molality, molaarisuus, jne.
näitä menetelmiä voidaan käyttää vain kilpailututkinnoissa.,
Suora Kaavoja Laskea Molaarisuudel-Molality ja:

Missä M = molaarisuus mol L-1-tai M –
m = molality mol kg-1 tai m
a = % massa liuenneen aineen
d = tiheys ratkaisu g/mL tai g cm-3.,
MB = Molekyyli massa liuenneen aineen grammaa
MA = molekyylimassa liuotin grammaa
Huomautus: Kun käytät näitä kaavoja, huolehtia, että määrät ovat määrätty yksikköä
molekyylimassojen tiettyjen aineiden grammaa:
Numeerisia Ongelmia Laskea Molaarisuudel-Molality ja:
Esimerkki – 01:
tiheys liuos, joka sisältää 13 painoprosenttia rikkihappoa on 1.09 g/mL. Laske molaarisuus ja normaaliuden ratkaisu,
Koska: a = 13, d = 1.09 g/mL
Löytää: Molaarisuus (M) =? ja normaalius (N)=?,
Ratkaisu:
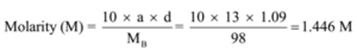
n = molekyylimassa/vastaava massa = 98 g/49 g = 2,
Normaaliuden = molaarisuus x n = 1.446 x 2 = 2.892 N
Esimerkki – 02:
tiheys 2,03 M etikkahappoliuosta (molekyylipaino = 60) vesi on 1.017 g/mL. Laske molality ratkaisu
Koska: M = 2.03, MB = 60 g mol-1, d = 1.017 g/mL
Löytää: – Molality (m) = ?,
Ratkaisu:

– molality = m = 1/0.4410 = 2.268 molal
Esimerkki – 03:
tiheys 10.0% massasta KCl-liuos vedessä on 1,06 g/mL. Laske KCL: n molaalisuus, molaarisuus ja mooliosuus.
Koska: a = 10, d = 1.06 g/mL
Löytää: Molaarisuus (M) =?, molaalisuus (m) =?, myyräfraktio (XB)=?
Ratkaisu:

Ans: Molaarisuus 1.,42 M, Molality = 1.491 m, Mole fraction = 0.0261
Example – 04:
0.8 M solution of H2SO4 has a density of 1.06 g/cm3. calculate molality and mole fraction
Given: M = 0.8 M, d = 1.06 g/cm3.
To Find: Molality (m) =?, mole fraction (XB) =?
Solution:

molality = m = 1/1.227 = 0.814 molal

0.814 x 18 x (1 – XB) = 1000 XB
14.,652 – 14.652 XB = 1000 XB
1014.652 XB = 14.652
XB = 14.652/1014.652 = 0.014
Esimerkki – 05:
6.90 M ratkaisu KOH vesi sisältää 30% massasta KOH. Laske liuoksen tiheys.
annettuna: M = 6,90 M, a = 30
löytääkseen: density of solution = d = ?
Ratkaisu:

Ans: Tiheys ratkaisu = 1.288 g/mL
Esimerkki – 06:
Koska: a = 10, d = 1.070 g cm-3,
Löytää: mooliosuus =? molaarisuus = ?, and molality =?
Solution:

Example – 07:
Calculate the mole fraction of solute in its 2 molal aqueous solution.
Given: molality = 2 molal
To Find: Mole fraction =?,
Solution:

Previous Topic: Numerical Problems on Molality
Next Topic: Solutions of Gases in Liquids
Vastaa