Science > Chimie > Solutions et leurs propriétés Colligatives > méthodes abrégées pour calculer la concentration de solutions
dans cet article, nous étudierons les méthodes abrégées pour calculer la molalité, la molarité, etc.
ces méthodes ne peuvent être utilisées que pour les concours.,
en Direct des Formules pour Calculer la molarité et la Molarité:

Où M = molarité en mol L-1 ou M
m = la molarité en mol kg-1 ou m
a = % par la masse de soluté
d = densité de la solution en g/mL ou g cm-3.,
MB = masse moléculaire du soluté en grammes
MA = masse moléculaire du solvant en grammes
Remarque: Lorsque vous utilisez ces formules, veillez à ce que les quantités soient en unités prescrites
masses moléculaires de certaines substances en grammes:
problèmes numériques pour calculer la molalité et la molarité:
exemple – 01:
la densité d’une solution contenant 13% en masse d’acide sulfurique est de 1,09 g/ml. Calculer la molarité et la normalité de la solution
étant donné: a = 13, d = 1,09 g/mL
pour trouver: molarité (m) =? et normalité (N) =?,
la Solution:
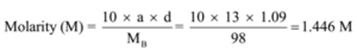
n = masse Moléculaire/masse équivalente = 98 g/49 g = 2
la Normalité = molarité x n = 1.446 x 2 = 2.892 N
Exemple – 02:
La densité de 2,03 M de la solution d’acide acétique (masse moléculaire = 60) dans l’eau est de 1.017 g/mL. Calculer la molalité de la solution
étant donné: M = 2,03, MB = 60 g mol-1, d = 1,017 g/mL
pour trouver: molalité (m) = ?,
la Solution:

la molarité = m = 1/0.4410 = 2.268 molal
Exemple – 03:
La densité de 10,0% en masse d’une solution de KCl dans l’eau est de 1,06 g/mL. Calculez la molalité, la molarité et la fraction molaire de KCl.
étant donné: a = 10, d = 1,06 g/mL
trouver: molarité (m) =?, molalité (m) =?, de la fraction molaire (XB) =?
la Solution:

Réponse: Molarité 1.,42 M, Molality = 1.491 m, Mole fraction = 0.0261
Example – 04:
0.8 M solution of H2SO4 has a density of 1.06 g/cm3. calculate molality and mole fraction
Given: M = 0.8 M, d = 1.06 g/cm3.
To Find: Molality (m) =?, mole fraction (XB) =?
Solution:

molality = m = 1/1.227 = 0.814 molal

0.814 x 18 x (1 – XB) = 1000 XB
14.,652 – 14,652 XB = 1000 XB
1014,652 XB = 14,652
XB = 14,652/1014,652 = 0,014
Exemple-05:
Une solution de KOH de 6,90 M dans l’eau contient 30% en masse de KOH. Calculez la densité de la solution.
Étant donné: M = 6,90 M, a = 30
Pour trouver: densité de solution = d = ?
la Solution:

Réponse: la Densité de la solution = 1.288 g/mL
Exemple – 06:
compte tenu de: a = 10, d = 1.070 g cm-3,
Pour Trouver: la fraction molaire =? molarité = ?, and molality =?
Solution:

Example – 07:
Calculate the mole fraction of solute in its 2 molal aqueous solution.
Given: molality = 2 molal
To Find: Mole fraction =?,
Solution:

Previous Topic: Numerical Problems on Molality
Next Topic: Solutions of Gases in Liquids
Laisser un commentaire