Einführung
Posteriore Harnröhrenklappen (PUV) ist die häufigste angeborene Ursache für pädiatrische Blasenauslassobstruktion (1). Während sich die Mortalitätsrate durch PUV mit dem modernen medizinischen Management signifikant verbessert hat, bleibt die obstruktive Uropathie bis ins Erwachsenenalter eine signifikante Quelle der Morbidität (2). Bis zu 80% der Kinder mit PUV zeigen Symptome von Inkontinenz und Harnwegsinfektionen (3)., Darüber hinaus entwickeln bis zu 50% der Kinder mit PUV Nierenversagen, wobei obstruktive Uropathie die häufigste angeborene Ursache für eine Nierentransplantation ist (4). Die obstruktiven Klappenblätter werden bald nach der Geburt chirurgisch behandelt; Kinder mit PUV entwickeln jedoch ein Leben lang eine Variabilität der Harnblasenfunktion. Es wurde gezeigt, dass eine Blasenverschlechterung häufig nach der Pubertät auftritt, wobei ein zunehmender Bedarf an sauberer intermittierender Katheterisierung besteht (5).
Studien mit verschiedenen Tiermodellen haben gezeigt, dass die Blase hormonell empfindlich ist., Insbesondere wurde gezeigt, dass ein Testosteronersatz das Verhältnis von glatter Muskelmasse und glatter Muskulatur zu Kollagen bei orchiektomierten Ratten erhöht (6). Ein Modell der partiellen Obstruktion des Blasenauslasses bei männlichen Mäusen wurde untersucht und es wurde gezeigt, dass es zu einer Blasendetrusormuskelhypertrophie kommt (7). Es wurde gezeigt, dass Testosteron die Detrusorfibrose als Reaktion auf eine Ischämie–Reperfusionsverletzung bei kastrierten Kaninchen erhöht (8). Bis heute muss jedoch die Wirkung hormoneller Manipulationen auf die Reaktion der männlichen Mäuseblase auf durch Obstruktion hervorgerufene Verletzungen noch untersucht werden., Daher stellen wir die Hypothese auf, dass Testosteron an den maladaptiven fibrotischen Veränderungen beteiligt ist, die nach einer Obstruktion des Blasenauslasses auftreten.
Materialien und Methoden
Murine Partial Blase Outlet Obstruction Model
Alle chirurgischen Eingriffe wurden vom Animal Care and Use Committee des Stanley Manne Children ‚ s Research Institute genehmigt. Männliche acht-bis zehnwöchige CD1-Mäuse (Charles River Labs, Chicago, IL, USA) wurden in separaten Käfigen untergebracht, um Veränderungen des Testosteronspiegels durch Gruppenunterkünfte zu vermeiden. Mäuse wurden mit 3% Isofluran betäubt und in Rückenlage positioniert., Der Unterbauch wurde rasiert und mit Aceton-Jod-Lösung zubereitet. Nach einer zufriedenstellenden Einleitung der Anästhesie wurde ein mittelförmiger Hautschnitt im Unterleib vorgenommen und durch die Bauchdecke getragen. Die Obstruktion des Blasenauslasses wurde auf ähnliche Weise wie in einem früheren Bericht durchgeführt, jedoch mit einigen Unterschieden (partielle Obstruktion oder PO-Gruppe) (7). Bitte beachten Sie, dass eine partielle Obstruktion typischerweise als „pBOO“ bezeichnet wird, Wir beziehen uns jedoch auf die chirurgische und experimentelle Gruppe als PO., Bei Aufwärtstraktion an der Blase wurde eine stumpfe Dissektion um den Blasenhals (proximal zur Prostata bei männlichen Mäusen) durchgeführt, während gelegentlich die Blase kaudal zurückgezogen wurde, um sicherzustellen, dass die Dissektion vor den Harnleitern lag. Eine 7-0 Polypropylennaht wurde dann um den Blasenhals geführt und über eine 23-Gauge-Nadel neben der Harnröhre gebunden. Die Nadel wurde dann entfernt., Wenn männliche Tiere kastriert werden sollten (Kastrat partielle Obstruktion oder CPO), wurden gleichzeitig die Hoden aus dem Bauchschnitt gebracht, die Samenstränge mit 6-0 Polypropylennähten ligiert und scharf geteilt. Die Bauchwand und die Haut wurden dann getrennt mit 5-0 Polyglactinnähten in einer unterbrochenen Weise verschlossen. Scheintiere wurden bis zur Blasenmobilisierung einem identischen Verfahren unterzogen. Die Tiere durften sich erholen, sofern Carprofen in Trinkwasser gelöst war, und nach 1 oder 4 Wochen nach den unten beschriebenen Funktionsstudien geopfert werden., Nach der Behandlung durch Halswirbelsäule Dislokation unter Isofluran Anästhesie, Tiere wurden gewogen und Blader wurden auf der Ebene der Ligatur seziert. Jede Blase wurde mit Urin entleert und dann separat für 12 Schein -, 17 PO -, 11 CPO-und 11 CPOT-Mäuse gewogen.
Testosteronverabreichung
Testosteron cypionate wurde der Kastraten -, teilweise verstopften Gruppe zum Zeitpunkt der Kastration und wöchentlich postoperativ in einer Dosis von 10 mg / kg verabreicht (Kastraten-Partialobstruktion Testosteron oder CPOT-Gruppe)., Bei Mäusen, denen ein Testosteronersatz verabreicht wurde, wurde zum Zeitpunkt des Todes Blut entnommen und zum kommerziellen Testosterontest geschickt, um sicherzustellen, dass sie einen angemessenen Ersatz erhielten (Antech Diagnostics, Irvine, CA, USA).
Voiding Fleck auf dem Papier (der VSOP)
VSOP erfolgte am morgen des postoperativen Tagen 1, 7 und 28 für jede Maus. Mäuse wurden in Stoffwechselkäfigen mit darunterliegendem Whatman-Filterpapier für 2 h gehalten und erhielten uneingeschränkten Zugang zu Nahrung und Wasser. Filter-Papier-Blätter abgebildet wurden., Anzahl und Muster der Hohlräume wurden festgestellt und die Fläche jedes Hohlraumflecks wurde mit ImageJ (National Institutes of Health, Bethesda, MD, USA) gemessen. Unter Verwendung einer Standardkurve, die aus Voiding Stains aus bekannten Urinvolumina erstellt wurde, wurde die Fleckenfläche in voided Volume umgewandelt. Max Leervolumen wurde analysiert.
Histologische Analyse
Blader wurden 24 h lang in 10% (w / v) Formalin (Sigma) fixiert, in Paraffin eingebettet und quer geschnitten, wobei der Blasenhals nach unten ausgerichtet war, um 4 µm-Abschnitte zu erzeugen. Abschnitte von 4 Sham -, 4 PO -, 4 CPO-und 4 CPOT-Mäusen wurden mit Massons Trichrome gefärbt., Abschnitte wurden mit 10× und 40× Vergrößerung mit einem Leica aufrecht Mikroskop an eine Kamera angeschlossen abgebildet und Bilder wurden digital mit OpenLab für Mac gespeichert. Das Col / SM-Verhältnis wurde wie zuvor beschrieben mit Adobe Photoshop quantifiziert und von vier 40× – Abschnitten pro Sekunde gemittelt. Für die Immunfärbung wurden Blasen in 4% (w/v) Formaldehyd aus Paraformaldehyd (EMA) über Nacht fixiert. Das Gewebe wurde in DPBS gewaschen und sequentiell in 20% (w/v) und 30% (w/v) Saccharose (Sigma) in DPBS ausgeglichen., Gewebe wurden in Peel-Away-Formen eingefroren, die OCT (Tissue Tech) in einem Trockeneis-Isopentan (Sigma) – Bad enthielten.
Immunfluoreszenz-Antikörper
Feste Blasen von 3 sham, 3 PO, 3 CPO, und 3 CPOT Mäuse verwendet wurden. Abschnitte von 10 µm ab wurden für alle Experimente geschnitten. Die Abschnitte wurden zweimal in PBS gewaschen, 5 min bei Raumtemperatur in PBS + 0,1% Tween (PBT) inkubiert und 30 min bei Raumtemperatur mit 10% Eselserum in PBT blockiert., Smooth muscle myosin (SMM) gefunden wurde auf die gleiche Weise mit Kaninchen-anti-smooth muscle myosin (Biomedical Technologies, 1:100) in Verbindung mit der Alexa Fluor 546 donkey anti-rabbit secondary antibody (Life Technologies, 1:400).
Statistische Analyse
Gruppen wurden mit ANOVA mit Post–hoc–Student-Newman-Keuls-Analyse verglichen. Ergebnisse mit P < 0.05 wurden als signifikant angesehen. SPSS v22. 0 wurde für die statistische Analyse verwendet. Fehlerbalken in Zahlen spiegeln SEM wider.,
Ergebnisse
PO Führt zu Funktionellen Veränderungen Bestimmt, die von gängigen urodynamischen Studien und Entwertung Fleck auf dem Papier
Teilweise Blase outlet-Obstruktion durchgeführt wurde, bei männlichen CD-1 Mäusen und verglichen zwei Gruppen: männliche Mäuse unterzogen sham Operation und männliche Mäuse unterzogen teilweise Blase outlet-Obstruktion mit Kastration. Wir maßen den Serumtestosteronspiegel in kastrierten Mäusen und stellten fest, dass der Spiegel innerhalb von 24 h nach Orchiektomie auf (<20 pg/dL) sank., Die Auswirkungen einer Obstruktion auf die Blasenfunktion wurden anhand urodynamischer Studien in diesen drei Gruppen bestimmt. Abbildung 1A zeigt erhöhte Spitzen-Leerdrücke 1 Woche nach der Obstruktion bei den PO – und CPO-Mäusen im Vergleich zu scheinchirurgischen Mäusen. Repräsentative urodynamische Tracings zeigen auch eine Instabilität nach 1 Woche bei PO – und CPO-Mäusen (Abbildung 1C). Die VSOP, die 1 Woche nach der Obstruktion durchgeführt wurde, spiegelt die Wirkung der Obstruktion auf PO-und CPO-Mäuse wider,die bei scheinchirurgischen Mäusen nicht beobachtet wird (Abbildungen 1B, D)., Somit hatte unser PO-Modell 1 Woche nach der Operation signifikante funktionelle Auswirkungen auf die Miktion sowohl bei PO-als auch bei CPO-Mäusen.
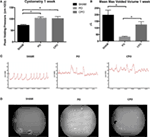
Abbildung 1. Cystometrie (A) und mittlere maximale leere Volumina (B) von Mäusen 1 Woche nach der PO. Spalten sind (von links nach rechts) Sham, PO, CPO. C) Repräsentative Spuren aus der Zystometrie-Analyse. (D) Repräsentative Bilder von Hohlflecken auf Whatman-Papier, die 2 h lang unter Mäusen platziert wurden, wie sie mit ultravioletter Bildgebung visualisiert wurden. Fehlerbalken sind SEM., Die statistische Signifikanz (P < 0.05) wird über Balken mit einem Sternchen angezeigt.
Obwohl die Obstruktion bei CPO-Mäusen nach 1 Woche nachgewiesen wurde, wurden die Auswirkungen der Obstruktion nach 4 Wochen behoben. VSOP bei 4 Wochen nach der Obstruktion durchgeführt zeigen, dass PO-Mäuse persistierende obstruktive Voiding-Muster mit kleineren maximalen Voided-Volumina als CPO-Mäuse haben. Gleichzeitig stellen CPO-Mäuse maximale Leervolumina wieder her, ähnlich wie scheinchirurgische Mäuse (Abbildungen 3A–C)., Das Gesamtmuster auf VSOP von CPO-Mäusen ist wieder normal, während PO-Mäuse weiterhin indiskretes Spritzen von Urin zeigen, was auf einen Verlust der Blasenkontrolle hinweist.
Blasenumbau nach PO wird durch Kastration verändert
Wir fanden heraus, dass Auswirkungen auf die Blasenfunktion mit makroskopischen Veränderungen in der Mausblase an PO-und CPO-Mäusen korreliert waren. Zum Zeitpunkt des Mausopfers nach 4 Wochen nach PO erschienen Scheinblasen normal groß, aber PO-und CPO-Blase waren stark vergrößert (Abbildungen 2A,C–E)., Nach der Dissektion der Blase distal zum Blasenhalsbandwurde der Urin ausgepresst und gewogen. Hier fanden wir ein erhöhtes Blasengewicht bei den PO-Mäusen im Vergleich zu den Scheinoperationen und CPO-Mäusen. CPO-Mäuse zeigten kein erhöhtes Gewicht im Vergleich zu scheinchirurgischen Mäusen (Abbildung 2B). Die histologische Auswertung der Blasen dieser Mäuse wurde mit H&E Färbung und Blasenbereich, Umfang und Dicke verglichen., Sowohl CPO-als auch PO-Mäuse zeigten im Vergleich zu scheinchirurgischen Mäusen eine erhöhte Fläche und einen erhöhten Umfang, was Veränderungen durch erhöhten Blasendruck nach PO widerspiegelte (Abbildungen 2F,H). Eine erhöhte Blasendicke wurde jedoch nur bei PO-Mäusen beobachtet (Abbildung 2G). Dies korrelierte mit den niedrigeren Blasengewichten bei CPO-Mäusen, was darauf hindeutet, dass die Zunahme der Blasengröße hauptsächlich auf eine „Dehnung“ des Blasenmuskels im Gegensatz zu einer echten Blasenmuskelhypertrophie oder-Hyperplasie zurückzuführen ist.
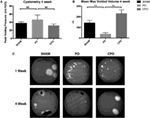
Abbildung 3., Cystometrie (A) und mittlere max voided Volumes (B) 4 Wochen nach Sham oder PO. (C) Repräsentative Bilder von Voiding-Flecken von Schein -, PO-oder CPO-Mäusen 1 und 4 Wochen nach der Operation. Fehlerbalken sind SEM. Die statistische Signifikanz wird über Balken mit Sternchen angegeben (**P < 0.01). NS zeigt an, dass der Unterschied statistisch nicht signifikant war.,
Blasenfibrose nimmt nach partieller Obstruktion des Blasenauslasses zu
Um zu untersuchen, ob die Zunahme der Blasenmasse und der Blasenwanddicke ausschließlich auf Muskelhypertrophie/Hyperplasie zurückzuführen war oder ob eine Komponente der Fibrose beteiligt war, wurde die histologische Untersuchung von Schein -, PO-und CPO-Mausbläsern 4 Wochen nach Obstruktion durchgeführt. Dies wurde unter Verwendung sowohl der Masson-Trichrom-Färbung als auch der Fibrosemarker-spezifischen Immunfluoreszenz durchgeführt (Abbildung 4)., Wie erwartet, in den PO Mäuse, folgende Behinderung, die Blasen waren gefunden zu haben, erhöht Col/SM-Verhältnisse. Bei der Kastration wurde das erhöhte Col / SM-Verhältnis nicht mehr gefunden (Abbildung 4B). Obwohl das luminale Blasenvolumen bei CPO-Mäusen erhöht war, zeigte die Muskelschicht keine Hypertrophie, wie durch die gleiche Blasenwanddicke wie bei scheinchirurgischen Mäusen belegt. Darüber hinaus zeigte die Auswertung der fibrose-spezifischen Marker Vimentin, Col1a1 und FSP-1 durch Immunfluoreszenz eine erhöhte Expression in PO-Mäusen im Vergleich zu Schein-Mäusen mit einer entsprechenden Abnahme der Expression in CPO-Mäusen., Es scheint, dass die Kastration Bedingungen schafft, unter denen ein nicht-fibrotischer Blasenumbau auftritt, und argumentiert für eine mögliche Rolle von Testosteron speziell bei der Vermittlung einer fibrotischen Reaktion auf Blasenverletzungen.
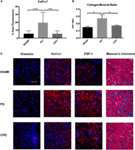
Abbildung 4. Vorhandensein von fibrotischen Proteinen in der Blasenwand nach PO. (A) Balkendiagramm, das die mittlere Prozentflächenfluoreszenz für Col1a1 zeigt. Bedeutung ist gekennzeichnet durch ***P < 0.001 oder ****P < 0.0001. (B) Balkendiagramm, das das Col/SM-Verhältnis in Schein -, PO-und CPO-Bladern zeigt., Die Signifikanz wird durch *P < 0.05 angezeigt. (C) Repräsentative Immunfluoreszenzbilder für Vimentin, Col1a1, FSP-1 und Masson-Trichrom. Der Fleck ist rot und DAPI Gegenfarbe ist blau. Reihen von Panels sind Abschnitte von (oben nach unten) Sham, PO und CPO. Zeilen sind links angegeben. Vergrößerungsleiste in der oberen linken Platte ist 100 µm und stellt die Vergrößerung für alle Platten.,
Einführung von exogenem Testosteron Kehrt die positiven Auswirkungen der Kastration nach partieller Blasenauslassobstruktion um
Wir haben gezeigt, dass die Kastration bei der Einstellung von PO den postobstruktiven Umbau in Bezug auf Blasenhypertrophie/Hyperplasie und Fibrose abschwächen wird. Um zu zeigen, dass dies eine testosteronspezifische Reaktion ist, wurde nach der Kastration eine Kohorte von Mäusen einer PO-und Testosteronergänzung unterzogen. Hier verwendeten wir entweder Testosteron oder sein reduziertes Produkt Dihydrotestosteron (DHT)., DHT hat die 10-fache Affinität zum Androgenrezeptor im Vergleich zu Testosteron und kann nicht zu Östrogen aromatisiert werden, wodurch die Wahrscheinlichkeit verringert wird, dass die Veränderungen, die durch Testosteronergänzung auftreten, auf steigende Östrogenspiegel zurückzuführen sind. Max storniert Volumen bestimmt durch VSOP waren signifikant niedriger als bei CPO plus Testosteron (CPOT) – oder CPO-plus DHT (CPOD) – Mäusen im Vergleich mit CPO-Mäusen (Abbildung 5A). Makroskopische und mikroskopische Veränderungen bei PO-Mäusen (aber nicht CPO-Mäusen) traten bei CPOT-und CPOD-Bladern wieder auf., Das Blasengewicht war bei CPOT-und CPOD-Mäusen im Vergleich zu CPO-Mäusen signifikant erhöht (Abbildung 5B). CPOT – und CPOD-Blader hatten im Vergleich zu CPO auch erhöhte Col / SM-Verhältnisse (Abbildung 5D). Fibrosemarker waren auch in CPOT und CPOD im Vergleich zu CPO-Bladern erhöht, ebenso wie die Reaktion auf Massons Trichromfleck (Abbildungen 5C, E). Diese Ergebnisse zeigen, dass der exogene Ersatz von Testosteron bei kastrierten männlichen Mäusen die pathologischen Wirkungen einer Obstruktion der Harnblase vollständig wiederherstellte., In Summe sind die Auswirkungen der Kastration und Testosteron-Ersatz-stark unterstützen eine Rolle für die männliche androgen in der Pathogenese der Blase Obstruktion.
Jungen, die mit PUV geboren wurden, werden kurz nach der Entbindung einer chirurgischen Resektion der obstruktiven Blättchen unterzogen. Trotz der Linderung der Obstruktion des Blasenauslasses bei diesen Kindern führen viele Patienten mit PUV zu einer Verschlechterung der Blase, die eine saubere intermittierende Katheterisierung erfordert, um die Blase angemessen zu entleeren (3). Diese Veränderungen wurden oft nach der Pubertät gesehen., Die klinischen Veränderungen bei Patienten mit resezierten Klappen wurden zuvor auf physiologische Veränderungen im Zusammenhang mit der Adoleszenz wie eine erhöhte Harnfiltration und nicht auf hormonelle Veränderungen zurückgeführt (1, 5, 9). Unsere Ergebnisse legen jedoch nahe, dass Androgen eine wichtigere Rolle spielen kann als bisher geschätzt. Wir stellen fest, dass das Vorhandensein oder Fehlen von Androgen spezifisch die zellulären Veränderungen beeinflusst, die nach einer Obstruktion auftreten, insbesondere Fibrose.,
Informationen aus Studien, in denen Testosteron bei Patienten mit Erkrankungen der unteren Harnwege ergänzt wurde, könnten einen Einblick in die Auswirkungen von Androgen auf Blasenerkrankungen geben. Diese Daten sind relativ spärlich und stammen größtenteils aus retrospektiven oder prospektiven Beobachtungsstudien und Studien, in denen Testosteron hypogonadalen oder eugonadalen Männern verabreicht wurde. Diese Studien legen jedoch nahe, dass die Testosteronergänzung die LUTS nicht verschlechtert (10, 11)., Insbesondere haben mehrere Studien eine Verbesserung des IPSS-Scores bei Männern gezeigt, die eine Androgenergänzung erhielten, obwohl viele von ihnen nicht speziell Männer mit bekannter Obstruktion des Blasenauslasses untersuchten, sondern eine Kohorte, die mit einer Testosteronergänzung behandelt wurde und zu Studienbeginn unterschiedliche Grade von LUTS aufweist. Eine Studie schloss Patienten mit bekannter Blasenhalsobstruktion aus. Koritsiadis et al., hat speziell Symptome und urodynamische Parameter in Druckflussstudien von hypogonadalen und eugonadalen Männern verglichen und festgestellt, dass der Serumtestosteronspiegel negativ mit dem Detrusordruck bei maximalem Fluss korreliert, jedoch nicht mit IPSS oder anderen urodynamischen Parametern (12).
Die Wirkung von Testosteron auf den Blasenentrusormuskel wurde auch in Tiermodellen untersucht. Tek und Kollegen fanden heraus, dass eine Testosteronergänzung von chirurgisch kastrierten Ratten zu einem verringerten Verhältnis von Kollagen zu glatter Muskulatur und einer erhöhten zystometrischen Kapazität führte (13). Shortliffe et al., (14) fanden heraus, dass der Testosteronersatz bei chirurgisch kastrierten Ratten auch mit einer erhöhten glatten Blasenmuskulatur sowie einer erhöhten Blasenmasse einherging (14). Zusammen zeigen diese Studien, dass Testosteron bei ungehinderten Ratten das Wachstum der glatten Muskulatur durch einen noch unklaren Mechanismus detrusorisch stimuliert. In einem Ischämie-Reperfusions-Blasenverletzungsmodell bei männlichen Kaninchen, Chuang et al. es zeigte sich, dass die Kastration durch abnehmende Blasenfibrose und verminderte Expression verschiedener fibrosebedingter Marker schützend war (8)., Die Testosteronergänzung dieser kastrierten Kaninchen führte nach einer Blasenverletzung zu einer erhöhten Detrusorfibrose. Unsere Ergebnisse spiegeln diese Ergebnisse wider und stellen die erste Studie zur Wirkung von Testosteron auf die Reaktion auf Blasenverletzungen durch PO bei jugendlichen Mäusen dar.
Gleichzeitig hat uns der Mangel an Erkenntnissen in der Literatur von unseren ersten Erkenntnissen überrascht. Ein potenzielles Problem, das wir hatten, war, dass die Mäuse nicht ausreichend behindert waren und dass unsere Ergebnisse bei kastrierten Mäusen eine Gruppe darstellten, in der einfach keine Obstruktion auftrat., Am Ende wissen wir, dass dies nicht zutrifft, da Blader in der CPO-Gruppe anfänglich Hohlflecken wie die blockierte Gruppe hatten, abnormalen Druck durch Zystometrie hatten und Blader umgebaut hatten. Tatsächlich waren die Blasen von CPO-Mäusen sehr unterschiedlich als Shams, was darauf hindeutet, dass die PO-Operation tiefgreifende Auswirkungen hatte. Unsere Interpretation dieser Befunde ist, dass in den Stunden nach der Operation der Druck innerhalb der Blasenwand zunimmt und dass bei normalen Mäusen Kollagene und andere Versteifungsmatrizen konstruiert werden, um ein Platzen der Blase in den Bauchraum zu verhindern., Blasen von CPO-Mäusen hatten eine sehr geringe Ablagerung von Kollagen innerhalb des Detrusormuskels, wurden aber gleichzeitig sehr groß mit dünnen Wänden. Wenn die fibrotische Reaktion in einer Hochdruckblase beeinträchtigt ist, dehnt sie sich möglicherweise aus, um den sich ansammelnden Urin aufzunehmen. Dies ist typisch für das, was wir in CPO beobachtet, aber nicht PO und CPOT Bladern. Daher stellen wir die Hypothese auf, dass die Rolle von Testosteron spezifisch bei der Vermittlung der Fibrose in der Blasenwand liegen kann.,
Während unsere Arbeit speziell ein Blasenmodell verwendete, um die Rolle von Testosteron bei Muskelfibrose als Reaktion auf Verletzungen der glatten Muskulatur zu bestimmen, glauben wir, dass sich diese Forschung als wichtig für viele fibrotische Krankheitsprozesse erweisen wird, die eine Geschlechtsassoziation haben. In der Tat wurde dies durch einige Studien in der Literatur unterstützt. Cho et al. gezeigt, dass Orchiektomie abgeschwächte Nierenfibrose nach Harnleiterobstruktion gesehen. In einem Mausmodell der einseitigen Harnleiterobstruktion zeigten Nieren von männlichen Mäusen eine erhöhte Expression von Alpha-SMA und Kollagenablagerung (15)., Ähnlich wie bei unserem Blasenmodell der Obstruktion wurde diese fibrotische Reaktion minimiert, wenn eine gleichzeitige Orchiektomie mit Ureterobstruktion durchgeführt wurde. Analoge Ergebnisse wurden berichtet in einem Maus-Modell der kardialen Fibrose sekundäre Druck überlast. Hier wurden fibrotische Veränderungen im linken Ventrikel durch Orchiektomie abgeschwächt. Dies beinhaltete eine Abstumpfung des TGFß-Signalwegs, von dem bekannt ist, dass er für die Förderung der Myofibroblastendifferenzierung wichtig ist (16). Die altersbedingte Herz – und Nierenfibrose wurde auch durch Orchiektomie bei männlichen Mäusen (17) abgeschwächt., Darüber hinaus war in einer Studie von Zhu und Kollegen der Androgenrezeptor an glatten Gefäßmuskelzellen an der testosteronstimulierten Verkalkung der glatten Muskulatur beteiligt. Unter Verwendung einer vaskulären glatten Muskelzellen, die von einer glatten muskelspezifischen Androgenrezeptor-Knockout-Maus abgeleitet wurden, wurde die Verkalkung als Reaktion auf die Testosteronbehandlung im Vergleich zu glatten Muskelzellen vom Wildtyp abgestumpft (18). Daher finden immer mehr Studien, einschließlich unserer, einen Zusammenhang zwischen Testosteron und den mit Fibrose verbundenen pathologischen Veränderungen.,
Der Mechanismus hinter der Rolle von Testosteron bei der Modulierung der Detrusorreaktion auf Verletzungen bleibt ungeklärt. Weitere Arbeiten zur Untersuchung der nachgeschalteten Wirkungen von Testosteron im Detrusormuskel könnten neuartige therapeutische Ziele aufzeigen, die verwendet werden könnten, um den nachteiligen Gewebeumbau, der bei der Einstellung von PO beobachtet wird, zu verhindern oder zumindest zu verbessern. Zusätzlich könnten Dosis-Wirkungs-Studien durchgeführt werden, um zu bestimmen, bei welchen Serumkonzentrationen von Testosteron zu einem nachteiligen Umbau führt. Es wurde gezeigt, dass Östrogen die Gewebehypoxie und die damit verbundene Detrusorverletzung in Tiermodellen abschwächt., Eine weitere Untersuchung des Zusammenspiels zwischen Testosteron und Östrogen bei der Modulation der Detrusormuskelreaktion auf Verletzungen kann ebenfalls dazu beitragen, diesen Weg weiter aufzuklären.
Schlussfolgerung
Jugendliche männliche Mäuse mit partieller Blasenauslassobstruktion haben kleinere Hochdruckblasen, die fibrotisch sind. Die Kastration war mit größeren Leervolumen, geringerem Blasengewicht und weniger Detrusorfibrose verbunden. Der Ersatz von Testosteron in Kastratmäusen hat diese Effekte umgekehrt., Dies zeigt an, dass Testosteron eine Rolle bei der Modifikation von Veränderungen des Detrusormuskels nach partieller Obstruktion des Blasenauslasses bei Mäusen spielt. Daher schlagen wir vor, dass erhöhte Testosteronspiegel bei Jungen mit PUV zur verminderten Blasenfunktion beitragen können.
Ethikerklärung
Diese Studie wurde gemäß den Empfehlungen des Ausschusses für chirurgische Richtlinien, Tierpflege und Verwendung durchgeführt. Das Protokoll wurde vom Animal Care and Use Committee.
Autor Beiträge
AF, PF, DB -, NK-und GS-Daten-Sammlung und-Analyse., AF, PF, RD und EG Konzeption, Design und Manuskript schreiben.
Interessenkonflikterklärung
Die Autoren erklären, dass die Untersuchung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Förderung
Diese Forschung wurde durch Fördermittel der Hartwell Association an EG unterstützt.
4. Holmdahl G, Sillen U. Jungen mit hinteren Harnröhrenklappen: Ergebnis in Bezug auf Nierenfunktion, Blasenfunktion und Vaterschaft im Alter von 31 zu 44 Jahre., J Urol (2005) 174(3):1031–4; discussion 1034. doi:10.1097/01.ju.0000170233.87210.4f
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Holmdahl G, Sillen U, Hanson E, Hermansson G, Hjalmas K. Bladder dysfunction in boys with posterior urethral valves before and after puberty. J Urol (1996) 155(2):694–8. doi:10.1097/00005392-199602000-00094
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Gallo CBM, Miranda AF, Felix-Patricio B, Ramos CF, Cardoso LEM, Costa WS, et al. Effects of castration and hormone replacement in the urinary bladder of rats: structural, ultrastructural, and biochemical analysis. J Androl (2012) 33(4):684–90. doi:10.2164/jandrol.111.014159
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Austin JC, Chacko SK, DiSanto M, Canning DA, Zderic SA., Ein männliches murines Modell der partiellen Blasenauslassobstruktion zeigt Veränderungen in der Detrusormorphologie, Kontraktilität und Myosin-isoformen Expression. J Urol (2004) 172(4 Pt 1):1524-8. doi:10.1097/01.ju.0000138045.61378.96
PubMed Abstract / CrossRef Volltext / Google Scholar
11. Yassin D-J, El Douaihy Y, Yassin AA, Kashanian J, Shabsigh R, Hammerer PG., Symptome der unteren Harnwege verbessern sich mit einer Testosteronersatztherapie bei Männern mit spät einsetzendem Hypogonadismus: 5-jährige prospektive, beobachtende und longitudinale Registerstudie. World J Urol (2014) 32(4):1049-54. doi:10.1007/s00345-013-1187-z
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cho MH, Jung KJ, Jang HS, Kim JI, Park KM. Orchiektomie dämpft Nierenfibrose nach Ureterobstruktion durch Reduktion von oxidativem Stress bei Mäusen. Am J Nephrol (2012) 35(1):7-16. doi:10.,1159/000334598
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Montalvo C, Villar AV, Merino D, Garcia R, Ares M, Llano M, et al. Androgens contribute to sex differences in myocardial remodeling under pressure overload by a mechanism involving TGF-beta. PLoS One (2012) 7(4):e35635. doi:10.1371/journal.pone.0035635
CrossRef Full Text | Google Scholar
17., Hewitson TD, Zhao C, Wigg B, Lee SW, Simpson ER, Boon WC, et al. Relaxin und Kastration bei männlichen Mäusen schützen vor altersbedingter Herz-und Nierenfibrose, Testosteron verschlimmert sie jedoch, während Östrogene eine unabhängige Determinante der Organgröße sind. Endokrinologie (2012) 153(1):188-99. doi:10.1210/en.2011-1311
PubMed Abstract / CrossRef Volltext / Google Scholar
18. Zhu D, Hadoke PW, Wu J, Vesey AT, Lerman DA, Dweck MR, et al., Ablation of the androgen receptor from vascular smooth muscle cells demonstrates a role for testosterone in vascular calcification. Sci Rep (2016) 6:24807. doi:10.1038/srep24807
PubMed Abstract | CrossRef Full Text | Google Scholar
Schreibe einen Kommentar