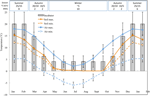
Abbildung 1. Monatliche maximale und minimale Luft – und Bodentemperaturdaten in den australischen Alpen (Mittelwert ± STDEV). Lufttemperaturen sind Mittelwerte aus der BOM-Datenbank, Bodentemperaturen wurden mit iButtons gemessen (siehe Methoden). Balken zeigen experimentelle Inkubatortemperaturen an (Mittelwert ± STDEV)., Die entsprechende Zeit des Jahres (Saison), Inkubator Temperaturregime (°C, 12/12 h, hell/dunkel) und Dauer der Behandlung (Wochen), wie in der oberen Platte angegeben.
Um Temperaturbedingungen in der Nähe derjenigen aufzudecken, bei denen Samen nach der Ausbreitung auftreten, wurden tägliche maximale und minimale Bodentemperaturdaten innerhalb des Untersuchungsgeländes (Seemannshütte; 36.27°S und 148.17°E, 2030 m ü.d.m.) mit Ibutton-Datenlogger (n = 10, Embedded Data Systems, USA) gesammelt, die vom 17.Januar bis 17. Dezember 2012 4 cm unter der Bodenoberfläche am Boden der Vegetation platziert wurden., Wir haben Logger bei 4 cm platziert, um Oberflächenstörungen zu vermeiden, aber immer noch repräsentativ für die Bedingungen zu sein, denen Samen im Boden ausgesetzt sind; Diese Tiefe ist zwischen dem, was in früheren alpinen Bodentemperaturüberwachungsübungen verwendet wurde (Scherrer und Körner, 2011; Pauli et al., 2015). Wie vermutet, fiel die durchschnittliche Bodentemperatur im Winter nicht unter den Gefrierpunkt (Abbildung 1). Im Sommer ist bekannt, dass die Bodentemperatur unter Vegetation die Umgebungstemperatur verfolgt, während die Temperaturen des nackten Bodens die Umgebungstemperatur um bis zu 15°C übersteigen (Soil Conservation Service unpublished Records, 1960s–1970s).,
Samensammlung und Keimung
Zwischen Januar und April 2009, 2010 und 2011 wurden reife Samen von 54 Arten aus 16 Familien und 37 Gattungen gesammelt (vollständige Namen und Behörden siehe Tabelle 1. Gutscheine wurden im Australian National Herbarium, Canberra) hinterlegt. Insgesamt repräsentierten die Arten mehr als ein Viertel der australischen Angiospermflora in alpinen Regionen (Costin et al., 2000, siehe Tabelle 1), obwohl sich viele dieser Arten auch unterhalb der Baumgrenze erstrecken., Die Lebensfähigkeit aller Sammlungen wurde vor der Aussaat unter experimentellen Keimbedingungen unter Verwendung der Tetrazoliumchlorid (TZ) – Färbetechnik (International Seed Testing Association, 2003) geschätzt. Weitere Informationen zur Erhebung und Verarbeitung finden Sie in Anhang A in ergänzendem Material.
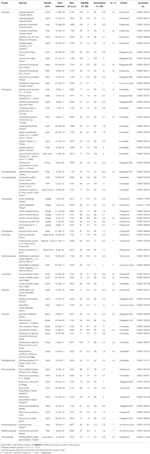
Tabelle 1. Untersuche Arten, Familie und Autorität, Wachstumsform und Sammlungsdetails, prozentuale Saatgutlebensfähigkeit (TZ-geschätzt, ± s. e.), endgültige prozentuale Keimung erreicht (± s.,), statistischer Unterschied zwischen Lebensfähigkeit und Keimung (G < V, nur in Fällen getestet, in denen die Keimung geringer als die Lebensfähigkeit war).
Die Phänologie der Samenkeimung wurde untersucht, indem Temperaturregime nachgeahmt wurden, die alpine Samen in situ nach der Ausbreitung in einem künstlich verkürzten Verlauf der Jahreszeiten erfahren. Samen wurden während des gesamten Experiments aufgenommen, so dass die Ergebnisse auf ein Keimungspotenzial hinweisen, wenn Wasser nicht begrenzt ist., Luft – und Bodentemperaturdaten (Abbildung 1) wurden verwendet, um Inkubatortemperaturregime zu leiten und zu validieren, obwohl die logistischen Gegensätze bei der Arbeit mit Inkubatoren die Einbeziehung der den natürlichen Bedingungen innewohnenden Schwankungen ausschlossen. Keimungstests verwendeten acht Replikate von 25 Samen pro Sammlung, die in Petrischalen mit einem Durchmesser von 9 cm ausgesät wurden, die 1% reinen Wasser-Agar enthielten. Petrischalen wurden mit Parafilm versiegelt, um eine Austrocknung des Agars zu vermeiden, bevor sie in Keiminkubatoren (Thermoline Scientific, Melbourne, NSW, Australien) gelegt wurden., Die Hälfte des Geschirrs wurde in Aluminiumfolie eingewickelt, um Licht auszuschließen und einen Hinweis auf den Lichtbedarf für die Keimung zu geben. Jedes der vier Replikate pro Lichtbehandlung pro Sammlung wurde auf ein anderes Regal innerhalb desselben Inkubators gestellt und der Standort innerhalb dieses Regals wurde wöchentlich neu angeordnet. Alle Replikate jeder Sammlung wurden durch die folgenden simulierten Thermoperioden bewegt: 8 Wochen bei 25/15°C (Tag/Nachttemperatur) → 2 Wochen bei 20/10°C → 2 Wochen bei 10/5°C → 10 Wochen bei konstant 4-5°C → 2 Wochen bei 10/5°C → 2 Wochen bei 20/10°C → 6 Wochen bei 25/15°C., So ahmte ein Zyklus des gesamten Experiments Temperaturen nach, die an Sommer, Frühherbst, Spätherbst, Winter, frühen Frühling, späten Frühling und Sommer erinnerten, und dauerte insgesamt 32 Wochen. Das verkürzte Jahr wurde als angemessen angesehen, da die Zugänge in einer bestimmten Behandlung im Allgemeinen die weitere Keimung eingestellt hatten, bevor sie auf die nächste „Saison“verschoben wurden., Eine Licht/Dunkel-Photoperiode von 12/12 h wurde durchgehend durch Leuchtstoffröhren bereitgestellt (> 90 µmol m−2 s−1 in der Mitte jedes Regals), und im Frühjahr, Sommer und Herbst fielen die Temperaturregime zusammen Licht fiel mit der warmen Temperaturperiode des Tages zusammen. Die Keimung, definiert als Radikula-Entstehung um mehr als 1 mm, wurde alle 7 Tage erzielt, und gekeimte Samen und Sämlinge wurden anschließend aus dem Geschirr entfernt. Die Keimung von folienumhüllten Platten wurde wie oben beurteilt, jedoch unter sehr niedrigem grünem Licht.,
Nach einem Versuchszyklus (32 Wochen) wurden die meisten Sammlungen beendet (siehe ergänzende Informationen für Ausnahmen), da zu diesem Zeitpunkt keine Keimung für mindestens 2 Wochen auftrat. Nach Beendigung wurden alle verbleibenden intakten Samen mit einem Skalpell unter einem Mikroskop seziert. Samen mit einem festen, frischen Endosperm und Embryo wurden als lebensfähig angesehen und Samen, die aus einem Embryo leer waren, wurden bei der Berechnung der prozentualen Keimung für jede Sammlung von der Gesamtmenge abgezogen., Wir berechneten einen Index der Lichtanforderungen für die Keimung für jede Art als Bruchteil der Keimung in der Dunkelbehandlung zu dem Zeitpunkt, zu dem kumulative Keimprozentile von 50 und 95% in der alternierenden Hell/Dunkel-Behandlung erreicht wurden (siehe unten).
Ökologische Korrelate der Keimstrategie
Aus veröffentlichten Daten haben wir eine Datenbank mit funktionellen Merkmalen und geografischen Maßnahmen von Arten zusammengestellt, um Korrelationen mit der Keimstrategie zu bewerten., Die Datenbank umfasste die folgenden kontinuierlichen Merkmale: durchschnittliche Samenmasse, leichter Keimbedarf (siehe oben), spezifische Blattfläche (Frischfläche/Trockenmasse), individuelle Blattfläche, individuelles Blatttrockengewicht und Reifegrad. Die minimalen, durchschnittlichen und maximalen Sammelhöhen für die Arten wurden aus allen Herbarium-Aufzeichnungen im australischen virtuellen Herbarium bestimmt, und die Höhe, in der die in der Studie verwendeten spezifischen Samensammlungen durchgeführt wurden, wurde auch als kontinuierliche Merkmale berücksichtigt. Wachstumsform wurde als eine von drei Kategorien bewertet: Graminoid, Kraut oder Strauch., Wir haben auch ein binäres Merkmal aufgenommen: ob die Samen endospermisch waren oder nicht.
Der Charakterzug Daten wurden aus einer Vielzahl von Quellen, darunter das Australian Virtual Herbarium (http://avh.chah.org.au/), der Australian National Herbarium specimen information register (https://www.anbg.gov.au/cgi-bin/anhsir), Kosciuszko Alpine Flora (Costin et al., 2000), der New South Wales Flora (Harden, 1990), und Der vergleichenden interne Morphologie von Samen (Martin, 1946). Samenmasse und spezifische Blattfläche wurden aus einzelnen Feldsammlungen erhalten, die in den Keimversuchen verwendet wurden., Die Samenmasse wurde durch Wiegen von vier Partien von 10 Samen erhalten. SLA wurde basierend auf fünf vollständig expandierten Blättern von einzelnen Individuen pro Art bestimmt. Diese wurden auf dem Feld gesammelt, auf einem Flachbettscanner gescannt, bei 60°C auf konstantes Gewicht getrocknet und auf die nächsten 0,000 g gewichtet. Wenn unzureichendes Saatgut verfügbar war oder eine bestimmte Blattfläche nicht verfügbar war, wurden Daten aus anderen ANBG-Sammlungen derselben Art oder aus anderen Datenquellen (S. Venn, unveröffentlichte Daten) erhalten., Ob ein Saatgut endospermisch war oder nicht, wurde aus Zeichnungen des Saatguts in den ANGB Seed Bank-Aufzeichnungen in Absprache mit Mitarbeitern der ANBG Seed Bank ermittelt. Die vollständige Datenbank und Quellen sind auf Anfrage bei den Autoren verfügbar.
Datenanalyse
Keimmuster wurden visuell und mittels einer Clusteranalyse in PC-ORD für Windows, Version 6 (MJM Software Design, Gleneden Beach, OR, USA) beurteilt. Die Analyse verwendete eine euklidische Abstandsmatrix und einen Verbindungsalgorithmus für den nächsten Nachbarn., Datenpunkte für die Clusteranalyse waren die Zeit (Wochen) bis zu bestimmten kumulativen Keimungsprozentilen (t20, t40, t50, t60, t80 und t95%) für jede Sammlung (gemittelt über die 4 Gerichte). So hätte eine Sammlung, die zu Beginn des Experiments gekeimt wurde, kurze Zeiten für Perzentile bis zu t80%, während eine Sammlung, die die Keimung aufgeschoben hat, bis die Temperaturen nach dem simulierten Winter gestiegen sind, lange Zeiten für diese Perzentile hätte., Komplexere Keimmuster, wie langsame, stetige Keimung oder Keimbrüche, könnten ebenfalls nachgewiesen werden und würden durch gleichmäßig verteilte Zeiten oder Zeiten angezeigt, die zu Beginn bzw. am Ende des Experiments gruppiert sind. Diese Methode wurde verwendet, um eine objektive Beurteilung des Keimungsmusters unabhängig von der Temperatur an sich zu erzwingen.,
Für die Replikatplatten jeder Sammlung wurde eine Einweganalyse der Varianz (ANOVA) durchgeführt, um festzustellen, ob ein signifikanter Unterschied zwischen der prozentualen Lebensfähigkeit (wie durch den TZ-Test bestimmt) und der endgültigen prozentualen Keimung bestand. Weitere Allgemeine lineare Modelle wurden verwendet, um zu beurteilen, ob die Cluster, die aus der cluster-Analyse unterschieden in der Tragfähigkeit oder endgültig Keimung Prozentsatz.
Assoziationen zwischen ökologischen Merkmalen und Keimstrategie-Clustern wurden auf zwei Arten getestet., Erstens haben wir auf mittlere Unterschiede zwischen Clustern getestet, indem wir ANOVA mit Cluster als festen Effekt und ökologischen Korrelaten als Antwortvariablen oder replizierte G-Tests für Endospermie und Wachstumsform verwendet haben. Zweitens haben wir diese Korrelationen anhand phylogenetischer Regressionen bewertet, da die Keimung und andere funktionelle Merkmale höchstwahrscheinlich von der Evolutionsgeschichte beeinflusst werden. Eine Phylogenie wurde gebaut für die Studie Arten mit Phylocom Phylomatic und die bladj Verpacken in R (Webb et al., 2008; R Core Team, 2013)., Wir untersuchten das Vorhandensein einer phylogenetischen Struktur in Variablen mit dem Phylosig oder Phylo.d (diskrete oder binäre Variablen) Funktion des Phytools-Pakets in R (Revell, 2012). Phylogenetische Regressionen wurden unter Verwendung der pgls-Funktion in Caper durchgeführt (Orme et al., 2013). Analysen, die durchgeführt wurden, in einem strukturierten Weise spiegelt das clustering revealed in PC-Ord (siehe unten)., Zunächst haben wir vier Keimstrategien (verschobene, sofortige und gestaffelte Kategorien innerhalb jeder der vorhergehenden), dann drei (alle gestaffelten Arten zusammenfassen und mit verschobenen und intermediären vergleichen) und schließlich Unterschiede zwischen den beiden breitesten Strategien bewertet, verschoben und intermediär.
Ergebnisse
Saatgutlebensfähigkeit Im Vergleich zur endgültigen Keimung
Insgesamt waren die Saatgutlebensfähigkeit und der Prozentsatz der endgültigen Keimung hoch. Die mittlere TZ-geschätzte Lebensfähigkeit aller Sammlungen betrug 80 ± 1.,7%, wobei mehr als zwei Drittel der Sammlungen mehr als 75% Lebensfähigkeit aufweisen (Tabelle 1). Es gab keinen Unterschied in der Qualität der Sammlungen über die 3-Jahre (die mittlere Lebensfähigkeit in den Jahren 2009, 2010 und 2011 betrug 79 ± 2.8, 80 ± 2.7 bzw. 81 ± 3.7%), was darauf hindeutet, dass die Anzahl der im Jahr 2009 gesammelten Samen ihre Lebensfähigkeit nicht verringerte.
Eine Keimung, die die TZ-geschätzte Lebensfähigkeit überschritt oder nicht signifikant unterschreitete, wurde für 45 der 54 Arten erreicht (Einweg-ANOVA: P>0.05, Tabelle 1)., Von den verbleibenden neun Arten war die Endkeimung von vier Arten trotz guter Lebensfähigkeit (ca. 55-94%), und so konnten wir keine Rückschlüsse auf die Keimstrategien dieser Arten ziehen. Das Ausbleiben der Keimung könnte entweder darauf hindeuten, dass unsere Behandlungen die Ruhephase nicht linderten oder dass die Samen bei der Entnahme nicht vollständig ausgereift waren. Schnitttests am Ende des Experiments zeigten, dass in allen Fällen die Mehrheit der nicht gekeimten Samen einen gesunden, aufgenommenen Embryo enthielt., Interessanterweise erreichten 34 Arten eine Keimung, die größer war als die TZ-geschätzte Lebensfähigkeit (Tabelle 1), was darauf hindeutet, dass der TZ-Test die Lebensfähigkeit von Samen häufig unterschätzte.
Keimhaufen
Die Clusteranalyse ergab zwei Hauptcluster (A und B) mit jeweils einer Unterstruktur (Abbildung 2). Für die Mehrzahl der Arten (n = 21 Arten aus 10 Familien) wurde die Keimung auf einen Zeitraum von Wintertemperaturen (5°C Tag/Nacht) oder bis zur Erhöhung der Temperaturen auf 10/5°C nach Winter verschoben (A1 und A1:Winter, Abbildungen 2, 3A)., Alternativ begann die Keimung sofort bei 25/15°C (n = 17 Arten, sechs Familien, in Cluster B1, Abbildungen 2, 3B). Bei der Mehrzahl dieser Arten war die Keimrate schnell; 50% der Gesamtkeimung (t50) traten in weniger als 3 Wochen auf (ergänzende Abbildung 1).
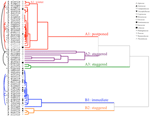
Abbildung 2. Cluster-Analyse-Dendrogramm basierend auf der Zeit bis zur kumulativen Keimung Perzentile (20, 40, 50, 60, 80, und 95%). Spezies angegeben durch Gattung Anfang und ersten Teil des Artennamens. Sternchen markieren Sammlungen, die vor dem Testen gesperrt wurden., Feine Bögen verbinden doppelte Sammlungen, um die Wirkung von Bakterien auf die Keimung zu vergleichen. Symbole bezeichnen verschiedene Familien (siehe Legende). Sammlungen, die in grauem Text angezeigt werden, sind diejenigen, die zwei Zyklen des Experiments ausgesetzt waren.
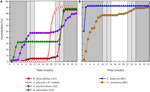
Abbildung 3. Kumulative prozentuale Keimung einer repräsentativen Spezies aus jedem Keimhaufen. (A) Cluster A, Arten, die die Keimung verschoben haben, (B) Cluster B, Arten, die sofort gekeimt sind., Beachten Sie, dass gestaffelte Keimmuster in den obigen Clustern verschachtelt sind. Inkubatortemperaturregime werden durch Schattierung dargestellt (siehe Abbildung 1).
Innerhalb jeder dieser breiten Klassen gab es jedoch klare Untercluster, die die Keimung widerspiegelten, die im Laufe der Zeit gestaffelt war, dh ein Teil der Samenmenge keimte vor der Exposition gegenüber Wintertemperaturen, während der Rest nach dem Winter keimte. Eine gestaffelte Keimung trat bei 13 Arten aus sechs Familien auf und trat hauptsächlich auf,wenn die Tagestemperaturen 10°C überstiegen (Abbildungen 3A, B)., Diese gestaffelten Keimer wurden in der Clusteranalyse in drei Gruppen eingeteilt. Cluster A2 mit sieben Sammlungen zeigte eine erhebliche Keimung sowohl vor als auch nach der kalten Temperaturperiode. Wo die Keimung aufhörte, bevor die Temperaturen geändert wurden, kamen wir zu dem Schluss, dass das Fehlen einer weiteren Keimung vor dem Winter nicht durch die Temperatur bestimmt wurde (A3). Im Gegensatz dazu schien die Keimung eines großen Teils der A2-Gruppe nur dann gestoppt zu werden, wenn die Temperaturen auf 10/5°C gesenkt wurden., Cluster B2 enthielt weitere vier Arten, die zu Beginn des Experiments eine erhebliche Keimung zeigten und einen relativ geringen Anteil ihrer Gesamtkeimung erreichten, nachdem die Temperaturen wieder über 5°C lagen (Abbildung 3B).
Im Vergleich zu der relativ geringen Variation unter den Arten innerhalb der Cluster A1 und B1 zeigen die gestaffelten Cluster auch eine viel größere Differenzierung zwischen den Arten. Die einzelnen Kurven für alle Arten sind in den ergänzenden Abbildungen 1i-vii. Detailliertere Angaben zur Keimstrategie finden Sie in Anhang B des ergänzenden Materials.,
Ökologische Korrelate der Keimstrategie
Von allen ökologischen Korrelaten, die wir in Betracht zogen, waren nur diejenigen, die direkt mit Samenmerkmalen assoziiert waren, signifikant mit der Keimstrategie korreliert, unabhängig davon, ob wir die Korrelation auf der Ebene von zwei Hauptclustern (verschoben vs. sofortige Keimung) oder auf der Ebene von drei oder vier Clustern bewerteten oder ob wir die phylogenetische Struktur berücksichtigten oder nicht (Tabelle 2)., Arten mit verzögerter Keimung hatten schwerere Samen und waren im Vergleich zu Arten, die sofort keimten, eher endospermisch (Abbildung 4). Arten mit gestaffelter Keimung waren in Samenmasse und Endospermie intermediär. Allerdings waren nicht alle Saatguteigenschaften mit der Keimstrategie korreliert: Es gab keine Korrelation zwischen den Lichtanforderungen für die Samenkeimung und der Strategie. Entgegen unseren Erwartungen zeigten Arten mit einer höheren spezifischen Blattfläche (möglicherweise ein Hinweis auf höhere Wachstumsraten) keine unmittelbare Keimung., Ebenso zeigten Arten mit höherer durchschnittlicher Höhe oder kleineren Höhenbereichen keine verzögerte Keimung.

Tabelle 2. Inzidenz der phylogenetischen Struktur in und korreliert von, Keimstrategie.
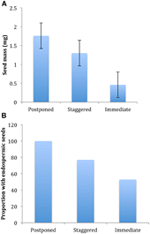
Abbildung 4., Unterschiede in (A) durchschnittlicher Samenmasse und (B) Anteil von Arten mit endospermischen Samen unter Arten mit verschobenen (Cluster A1), gestaffelten (Kombination von Cluster A2, A3 und B2) und sofortigen Keimstrategien (Cluster B1). Unterschiede zwischen den Strategien sind bei P ≤ 0,05 signifikant, siehe Tabelle 2.
Die Keimung in alpinen Lebensräumen wurde historisch als umweltfreundlich eingestuft, wobei Winterschnee Samen gegen potenzielle Keimhinweise isolierte und die Ruhephase unnötig machte (Billings und Mooney, 1968)., Unsere Ergebnisse stützen jedoch neuere Beweise dafür, dass Ruhemechanismen sowohl in Australien als auch in den Alpen häufig sind (Hoyle et al., 2013; Sommerville et al., 2013) und anderswo auf der ganzen Welt (Cavieres und Arroyo, 2000; Schütz, 2002; Shimono und Kudo, 2005; Mondoni et al., 2009; Schwienbacher et al., 2011)., Die Ruhephase scheint eine bedeutende Rolle bei der Kontrolle des In-situ-Zeitpunkts der Keimung vieler australischer alpiner Arten zu spielen, um die Keimungsrate zu verzögern, zu verschieben oder zu verlangsamen und somit möglicherweise risikoaverse Regenerationsstrategien in einer rauen und variablen Umgebung zu verleihen. Das vielleicht auffälligste unserer Keimergebnisse war der Anteil der Arten, für die die Keimstrategie innerhalb einer Samensammlung für eine bestimmte Art variierte, was darauf hindeutet, dass sowohl ruhende als auch nicht ruhende Eigenschaften innerhalb derselben Samensammlung dieser Arten gezeigt wurden., Insbesondere waren Keimstrategien im Allgemeinen innerhalb von Familien stark konserviert und korrelierten auch mit Elementen der Samenanatomie: Masse und Endospermie. Keimstrategien waren jedoch unabhängig von anderen ökologisch signifikanten Funktionsmerkmalen der reifen Pflanze.
Variation der Keimstrategie
Samen von fast der Hälfte der untersuchten Arten schienen nicht keimen zu können, bis sie einer kühlen, nassen Periode (konstante 5°C) ausgesetzt waren, was darauf hindeutet, dass die kalte Schichtung einen physiologischen Ruhemechanismus milderte., Die Verschiebung der Keimung auf das folgende Frühjahr kann es den Sämlingen ermöglichen, die Etablierung über oder vor dem harten Winter zu vermeiden und gleichzeitig die kurze bevorstehende Vegetationsperiode zu optimieren. Im Gegensatz dazu kann die opportunistische Keimung der Arten, die sofort keimten, einen selektiven Vorteil bieten, wenn das Risiko einer winterlichen Sämlingsmortalität gering ist, indem Pflanzen früher im folgenden Frühjahr oder in größerer Größe blühen können (Donohue, 2002).,
Bisher gab es wenig veröffentlichte Hinweise auf eine intra-spezifische Variabilität der Ruhemechanismen innerhalb alpiner Samensammlungen, wie sie die hier beobachteten gestaffelten Keimstrategien erklären würden. Die im Laufe der Zeit gestaffelte Keimung kann auch durch unterschiedliche Samenreife bei Individuen in der Population zum Zeitpunkt der Sammlung erklärt werden und/oder eine dimorphe Strategie innerhalb einer einzelnen Pflanze widerspiegeln, die mit der Position auf der Pflanze oder dem Zeitpunkt der Entwicklung verbunden ist.,
Evolutionäre Bet-Hedging wird oft hervorgerufen, um die diversifizierte Strategie in den Samenkeimeigenschaften zu erklären (Simons, 2011), wie sie durch die Sammlungen mit gestaffelter Keimung demonstriert wird. Wenn jedoch eine diversifizierte Strategie sowohl zu einer erhöhten durchschnittlichen Fitness als auch zu einer Verringerung der Varianz führt (z. B. durch Verringerung des Wettbewerbs zwischen Geschwistern), stellt sie keine Wettabsicherung dar. Ebenso, wenn die scheinbare Diversifikation Unterschiede zwischen, nicht innerhalb, Individuen widerspiegelt, dann ist es nicht Bet-Hedging (Starrfelt und Kokko, 2012)., Untersuchungen zu den Ausbreitungsmustern alpiner Sämlinge und der Toleranz von Frost und Schneeschmelze, gepaart mit Studien zu Determinanten der Variation der Keimstrategie innerhalb von Arten, kann dazu beitragen, die Keimphänologie der Arten zu erklären, die eine gestaffelte Strategie aufweisen, und kann darauf hinweisen, ob sie wahrscheinlich Strategien zur Absicherung von Wetten darstellen.,
Ökologische Korrelate der Keimstrategie
Unsere Untersuchung der Beziehung zwischen Keimstrategie und anderen ökologisch wichtigen Merkmalen zeigte, dass Keimmerkmale mit anderen Samenmerkmalen korreliert waren, jedoch nicht mit vegetativen Merkmalen. Sommerville et al. (2013) fanden heraus, dass australische Alpenkräuter mit nicht-endospermischen Samen bei der Ausbreitung eher nicht schlummern. Unsere Arbeit unterstützt diesen Befund und zeigt weiter, dass kleinere Samen eher zu den unmittelbaren Keimern gehören. Obwohl Sommerville et al., (2013) gar nicht postulieren, warum endospermy kann verbunden sein mit Ruhe, wir schlagen vor, die Platzierung von Reserven in der Keimblätter verbessern können frühzeitig Wachstum und Etablierung in unmittelbarer keimenden Arten. Unsere Ergebnisse haben keinen Hinweis auf eine Korrelation zwischen Licht-Anforderung und Schlafzustand, obwohl Licht Anforderungen haben, variieren zwischen den Arten. Es gibt eine Vielzahl anderer Saatgutmerkmale, die das Aussterberisiko in variablen Umgebungen puffern, zum Beispiel Saatgutverteilungsmechanismen und Saatgutlebensdauer in der Bodensamenbank (siehe Tielborger et al., 2012 für eine Überprüfung)., In diesem Stadium können wir nicht sagen, ob diese Merkmale Korrelationen mit der Keimstrategie zeigen würden oder nicht.
Wir fragten weiter, ob die Keimstrategie mit ökologisch wichtigen nicht reproduktiven Merkmalen wie spezifischer Blattfläche oder Pflanzenhöhe korreliert (Westoby, 1998; Wright et al., 2004). Insbesondere haben wir vermutet, dass die unmittelbar keimenden Arten Merkmalswerte aufweisen könnten, die auf schnellere Wachstumsraten hinweisen (unter Verwendung von SLA als Proxy), wie dies für die Etablierung in der kurzen Zeit zwischen der Ausbreitung und dem Einsetzen des Winters erforderlich sein könnte., Wir haben jedoch keine solchen Zusammenhänge gefunden. Ob physiologische und Wachstumsmerkmale von Sämlingen in frühen Gründungsstadien andere Muster aufweisen können als erwachsene vegetative Merkmale, ist eine Frage, die berücksichtigt werden sollte, die jedoch über den Rahmen der vorliegenden Arbeit hinausgeht.
Schließlich untersuchten wir, ob Arten aus höheren Lagen, in denen die Vegetationsperioden im Allgemeinen kürzer sind, eher eine Ruhephase aufweisen, aber es gab keinen Zusammenhang zwischen Höhenbereich, Sammelhöhen oder der durchschnittlichen Sammelhöhe für die Art als Ganzes und Keimstrategie., Zusammen deuten diese Ergebnisse darauf hin, dass die Entwicklung der Keimstrategie zwar eng mit ökologisch wichtigen Samenmerkmalen verbunden ist, sie jedoch eine weitgehend unabhängige Achse zu vegetativen oder Verteilungsmerkmalen umfasst.
Auswirkungen auf die alpinen Pflanzengesellschaften, die in einem sich Verändernden Klima
Australian alpine ökosysteme, wie die alpinen Gebiete rund um die Welt, bedroht durch den Klimawandel, verbunden mit änderungen im Feuer Frequenz, Landnutzung, Zustrom von invasiven Arten und die Auswirkungen der zunehmenden menschlichen Erscheinung., Die mit dem Klimawandel verbundene Erwärmung tritt schneller über der Baumgrenze auf als in niedrigeren Lagen, und es wird prognostiziert, dass die alpinen Gebiete auch in Zukunft eine überdurchschnittliche Erwärmung erfahren werden (Kullman, 2004). Die Fähigkeit zur fortgesetzten Regeneration über Saatgut unter neuartigen Bedingungen dürfte eine bedeutende Rolle bei der Reaktion alpiner Pflanzen auf das Klima und die damit verbundenen Veränderungen spielen. Darüber hinaus erfordern veränderte Störungsregime wahrscheinlich eine erhöhte Rolle der Wiederherstellung und Rehabilitation in der Region., Die hier gewonnenen Erkenntnisse sind daher von entscheidender Bedeutung für die Erhaltung und Bewirtschaftung von alpinen Systemen im Wandel; Sie können dazu beitragen, unsere Vorhersagen darüber zu informieren, wie viele Arten betroffen sein könnten, die Grundlage für Saatgutvermehrungspläne für diese Arten bilden und verwendet werden, um zukünftige Untersuchungen zu alpinen Saatgutkeimungsstrategien mit identifizierbaren Erhaltungs-und Bewirtschaftungsergebnissen zu leiten.,
Temperaturänderungen beeinflussen wahrscheinlich den Ruhestatus von Samen sowohl vor als auch nach der Dispersion, wodurch die Keimstrategien verändert und / oder gestört werden und sich die derzeitige Keimphänologie verschiebt (Hoyle et al., 2008b). Für alpine Pflanzen kann die Klimaerwärmung zu einer Verschiebung von der Frühjahrs-auf die Herbstentwicklung führen, die hauptsächlich auf Veränderungen des Saatgutschlafstatus zurückzuführen ist und zu erheblichen Auswirkungen auf Arten führt, die derzeit an die Entstehung im Frühjahr angepasst sind (Mondoni et al., 2012)., Weitere Untersuchungen darüber, wie Temperaturänderungen, die Samen nach der Ausbreitung erfahren, eine verkürzte Dauer der Schneedecke und eine erhöhte Häufigkeit extremer Temperaturereignisse die Keimung beeinflussen, sind erforderlich, um vorherzusagen, wie Arten mit Ruhe auf den Klimawandel reagieren werden. Für die alpinen Arten, die im Herbst vor Frost und Schneefall keimen, werfen unsere Ergebnisse die Frage auf, wie Sämlinge dieser Arten mit der vorhergesagten Niederschlagsreduzierung und der erhöhten Häufigkeit von a-saisonalen Frostereignissen fertig werden.,
Schließlich werfen unsere Ergebnisse wichtige Fragen zur Variation innerhalb der Arten auf, insbesondere im Zusammenhang mit der Vorhersage der Auswirkungen des Klimawandels oder der Auswahl der Samen, die für die Wiederherstellung verwendet werden sollen. Keimstrategien können innerhalb der Arten variieren, abhängig von Population, Blütezeit, Samenmasse, elterlicher Investition, Klima, Höhe und/oder mütterlicher Umgebung, und diese Variation kann genetische, epigenetische und/oder Umweltfaktoren widerspiegeln (Cochrane et al., 2015)., Zunehmende Höhenunterschiede erklären die Variation der Keimfähigkeit und / oder des Ruhezustands mehrerer alpiner Arten (Billings und Mooney, 1968; Dorne, 1981; Cavieres und Arroyo, 2000), siehe aber (Hoyle et al., 2014). Ein reduzierter Ruhezustand kann sich aus einer vorzeitigen Beendigung der Samenentwicklung aufgrund von Umweltbelastungen ergeben (Steadman et al., 2006; Hoyle et al., 2008b)., Die Untersuchung von Variationen der Keimstrategien innerhalb von Arten kann das Potenzial für Arten aufdecken, mit Klimaveränderungen fertig zu werden und sich an sie anzupassen, was eine wichtige Rolle bei der Bestimmung des zukünftigen Überlebens und der Artenverteilung spielt und wichtige Einblicke für Management und Erhaltung bietet.
Schlussfolgerungen
Unser Ansatz hat ein weit verbreitetes Auftreten von Ruhephasen in der australischen Alpenflora aufgedeckt und zeigt, dass Keimstrategien sowohl innerhalb einer Samensammlung als auch zwischen den Sammlungen variieren., Darüber hinaus haben wir gezeigt, dass die Ruhestrategie zwar phylogenetisch konserviert und mit Samenmasse und Endospermie korreliert ist, jedoch weitgehend unabhängig von vegetativen Merkmalen und Reichweitenmerkmalen ist. Während man aus unseren Ergebnissen nicht direkt extrapolieren kann, wie sich das Klima und die damit verbundenen Veränderungen auf die Alpenflora auswirken werden, können diese Ergebnisse die Grundlage für die Gestaltung von Ausbreitungsplänen und weitere Experimente zu den Auswirkungen sich ändernder Klimaregime bilden., Insbesondere befürworten wir weitere Forschungen zum Verständnis der Ursachen von Variationen innerhalb der Arten in der Keimstrategie und der Rolle, die dies für die Fähigkeit der Arten spielen kann, dem vorhergesagten Klimawandel standzuhalten.
Datenzugänglichkeit
Vollständige Keimdaten und Merkmalsdatenbanken werden auf DRYAD und beim Atlas of Living Australia hinterlegt.
Interessenkonflikterklärung
Die Autoren erklären, dass die Untersuchung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.,
Anerkennungen
Wir bestätigen die Finanzierung durch den Australian Research Council (LP0991593) und den Australian National Botanic Garden und dessen Freunde. Wir danken J. McAuliffe, S. Fethers, und S. Lawatsch der ANBG. Wir danken auch M. Holloway-Phillips, M. Cardillo und S. Cunningham für die Eingabe zu früheren Versionen des Manuskripts und für analytische Beratung und S. Venn für den Zugriff auf Merkmalsdaten.
Ergänzendes Material
Foley, M. E. (1992). Wirkung von löslichen Zuckern und Gibberellic-Säure in der Ruhephase von ausgeschnittenen Wild Hafer (Avena fatua) Embryonen., Weed Sci. 40, 208–214.
Google Scholar
Harden, G. J. (1990). Flora von New South Wales. Sydney, NSW: Royal Botanic Gardens.
Google Scholar
International Seed Testing Association. (2003). Arbeitsblätter zu Tetrazolium-Tests. Bassersdorf: ISTA.
Kullman, L. (2004). Das sich verändernde Gesicht der alpinen Welt. Glob. Ändern Sie Newsl. 57, 12–14.
Google Scholar
Schreibe einen Kommentar