Scienza > Chimica > Soluzioni e le Proprietà Colligative > taglio Corto Metodi Per il Calcolo della Concentrazione delle Soluzioni
In questo articolo, si è scelto di studiare taglio corto metodi per calcolare molality, molarità, etc.
Questi metodi possono essere utilizzati solo in concorsi.,
Diretta Formule per Calcolare Molality e Molarità:

Dove M = molarità in mol L-1 o M
m = molality in mol kg-1 o m
a = % da massa di soluto
d = densità della soluzione in g/mL o g cm-3.,
MB = massa Molecolare del soluto in grammi
MA = massa Molecolare del solvente in grammi
Nota: Quando si utilizzano queste formule, fare attenzione che le quantità sono prescritte unità.
masse Molecolari di alcune sostanze in grammi:
Problemi Numerici per Calcolare Molality e Molarità:
Esempio – 01:
La densità di una soluzione contenente il 13% (massa) di acido solforico è 1.09 g/mL. Calcola la molarità e la normalità della soluzione
Dato: a = 13, d = 1,09 g/mL
Per trovare: Molarità (M) =? e Normalità (N) =?,
Soluzione:
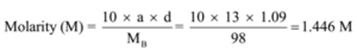
n = massa Molecolare/massa equivalente = 98 g/49 g = 2
la Normalità = molarità x n = a 1.446 x 2 = 2.892 N
Esempio – 02:
La densità di 2.03 M soluzione di acido acetico (massa molecolare = 60) in acqua è 1.017 g/mL. Calcola molalità della soluzione
Dato: M = 2.03, MB = 60 g mol-1, d = 1.017 g/mL
Per trovare: Molalità (m) = ?,
Soluzione:

molality = m = 1/0.4410 = 2.268 molal
Esempio – 03:
La densità di 10.0% (massa) di KCl soluzione in acqua è di 1,06 g/mL. Calcola la molalità, la molarità e la frazione molare di KCl.
Dato: a = 10, d = 1,06 g/mL
Per trovare: Molarità (M) =?, molalità (m) =?, frazione molare (XB) =?
Soluzione:

Ans: Molarità 1.,42 M, Molality = 1.491 m, Mole fraction = 0.0261
Example – 04:
0.8 M solution of H2SO4 has a density of 1.06 g/cm3. calculate molality and mole fraction
Given: M = 0.8 M, d = 1.06 g/cm3.
To Find: Molality (m) =?, mole fraction (XB) =?
Solution:

molality = m = 1/1.227 = 0.814 molal

0.814 x 18 x (1 – XB) = 1000 XB
14.,652 – 14.652 XB = 1000 XB
1014.652 XB = 14.652
XB = 14.652/1014.652 = 0.014
Esempio-05:
Una soluzione da 6,90 M di KOH in acqua contiene il 30% in massa di KOH. Calcola la densità della soluzione.
Dato: M = 6,90 M, a = 30
Per trovare: densità della soluzione = d=?
Soluzione:

Ans: la Densità della soluzione = 1.288 g/mL
Esempio – 06:
Dato che: a = 10, d = 1.070 g cm-3,
Per Trovare: frazione molare =? molarità = ?, and molality =?
Solution:

Example – 07:
Calculate the mole fraction of solute in its 2 molal aqueous solution.
Given: molality = 2 molal
To Find: Mole fraction =?,
Solution:

Previous Topic: Numerical Problems on Molality
Next Topic: Solutions of Gases in Liquids
Lascia un commento