Wetenschap > Scheikunde > Oplossingen en Hun Colligatieve Eigenschappen > Short-cut) Methoden Voor de Berekening van de Concentratie van de Oplossingen
In dit artikel, we zullen study short-cut methoden voor het berekenen van molality, molarity, enz.
deze methoden kunnen alleen worden gebruikt in competitieve examens.,
directe formules om molaliteit en molariteit te berekenen:

waarbij M = molariteit in mol L-1 of M
M = molaliteit in mol kg-1 of m
a = Massaprocent van de opgeloste stof
d = dichtheid van de oplossing in g/ml of g cm-3.,
MB = molecuulmassa van de opgeloste stof in gram
MA = molecuulmassa van het oplosmiddel in gram
Opmerking: let er bij gebruik van deze formules op dat de hoeveelheden in voorgeschreven eenheden zijn
molecuulmassa van bepaalde stoffen in gram:
numerieke problemen bij de berekening van molaliteit en molariteit:
voorbeeld – 01:
de dichtheid van een oplossing met 13 massaprocent zwavelzuur bedraagt 1,09 g/ml. Bereken de molariteit en normaliteit van de oplossing
gegeven: a = 13, d = 1,09 g/mL
om te vinden: molariteit (M) =? en normaliteit (N) =?,
oplossing:
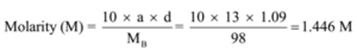
n = molecuulmassa/equivalente massa = 98 g/49 g = 2
normaliteit = molariteit x n = 1.446 x 2 = 2.892 N
voorbeeld – 02:
de dichtheid van 2,03 m oplossing van azijnzuur (molecuulmassa = 60) in water is 1,017 g/ml. Bereken de molaliteit van de oplossing
gegeven: m = 2,03, MB = 60 g mol-1, d = 1,017 g/mL
om te bepalen: molaliteit (m) = ?,
oplossing:

molaliteit = m = 1/0.4410 = 2.268 molal
voorbeeld – 03:
de dichtheid van 10,0 massaprocent van KCl-oplossing in water is 1,06 g/ml. Bereken de molaliteit, molariteit en molfractie van KCl.
gegeven: a = 10, d =1,06 g/mL
vinden: molariteit (M)=?, molaliteit (m)=?, molfractie (XB)=?
oplossing:

Ans: molariteit 1.,42 M, Molality = 1.491 m, Mole fraction = 0.0261
Example – 04:
0.8 M solution of H2SO4 has a density of 1.06 g/cm3. calculate molality and mole fraction
Given: M = 0.8 M, d = 1.06 g/cm3.
To Find: Molality (m) =?, mole fraction (XB) =?
Solution:

molality = m = 1/1.227 = 0.814 molal

0.814 x 18 x (1 – XB) = 1000 XB
14.,652-14.652 Xb = 1000 XB
1014.652 XB = 14.652
XB = 14.652/1014.652 = 0,014
voorbeeld – 05:
een oplossing van 6,90 m Koh in water bevat 30 massaprocent KOH. Bereken de dichtheid van de oplossing.
gegeven: m = 6,90 m, a = 30
om: dichtheid van de oplossing = d=?
Oplossing:

Ans: de Dichtheid van de oplossing = 1.288 g/mL
Voorbeeld – 06:
Gegeven: a = 10, n = 1.070 g cm-3,
Te Vinden: molfractie =? molariteit = ?, and molality =?
Solution:

Example – 07:
Calculate the mole fraction of solute in its 2 molal aqueous solution.
Given: molality = 2 molal
To Find: Mole fraction =?,
Solution:

Previous Topic: Numerical Problems on Molality
Next Topic: Solutions of Gases in Liquids
Geef een reactie