Nauka > Chemia > roztwory i ich właściwości Koligacyjne > krótkie metody obliczania stężenia roztworów
w tym artykule przeanalizujemy krótkie metody obliczania molalności, molarności itp.
metody te mogą być stosowane tylko w egzaminach konkursowych.,
bezpośrednie wzory do obliczania Molowości i Molowości:

gdzie M = molowość w mol L-1 lub m
m = molalność w Mol kg-1 lub M
A = % masy substancji rozpuszczonej
d = gęstość roztworu w g/ml lub g cm-3.,
MB = Masa cząsteczkowa substancji rozpuszczonej w gramach
ma = Masa cząsteczkowa rozpuszczalnika w gramach
Uwaga: podczas stosowania tych wzorów należy zadbać o to, aby ilości były w zalecanych jednostkach
masy cząsteczkowe niektórych substancji w gramach:
problemy numeryczne w celu obliczenia Molalności i molarności:
przykład – 01:
gęstość roztworu zawierającego 13% masy kwasu siarkowego wynosi 1,09 g / ml. Oblicz molarność i normalność roztworu
Podane: a = 13, d = 1,09 g/mL
aby znaleźć: molarność (M) =? a normalność (N)=?,
rozwiązanie:
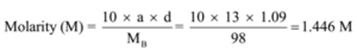
n = Masa cząsteczkowa/masa równoważna = 98 g/49 g = 2
normalność = molarność x n = 1,446 X 2 = 2,892 n
przykład – 02:
gęstość 2,03 m roztworu kwasu octowego (Masa cząsteczkowa = 60) w wodzie wynosi 1,017 g / ml. Oblicz molalność roztworu
Podane: M = 2,03, MB = 60 g mol-1, d = 1,017 g/mL
aby znaleźć: Molalność (m) = ?,
rozwiązanie:

molality = m = 1/0.4410 = 2,268 molal
przykład – 03:
gęstość 10,0% masowo roztworu KCl w wodzie wynosi 1,06 g/ml. Oblicz molalność, molarność i ułamek molowy KCl.
Podane: a = 10, d = 1,06 g/mL
aby znaleźć: molarność (M)=?, molalność (m) =?, ułamek molowy (XB) =?
rozwiązanie:

Ans: Molarity 1.,42 M, Molality = 1.491 m, Mole fraction = 0.0261
Example – 04:
0.8 M solution of H2SO4 has a density of 1.06 g/cm3. calculate molality and mole fraction
Given: M = 0.8 M, d = 1.06 g/cm3.
To Find: Molality (m) =?, mole fraction (XB) =?
Solution:

molality = m = 1/1.227 = 0.814 molal

0.814 x 18 x (1 – XB) = 1000 XB
14.,652 – 14.652 XB = 1000 XB
1014.652 XB = 14.652
XB = 14.652/1014.652 = 0.014
przykład-05:
6,90 M roztwór Koh w wodzie zawiera 30% masy KOH. Oblicz gęstość roztworu.
Podane: M = 6,90 m, a = 30
do znalezienia: gęstość roztworu = d = ?
rozwiązanie:

Ans: gęstość roztworu = 1,288 g/mL
przykład – 06:
Podane: a = 10, d = 1.070 g cm-3,
aby znaleźć: ułamek molowy =? molarność = ?, and molality =?
Solution:

Example – 07:
Calculate the mole fraction of solute in its 2 molal aqueous solution.
Given: molality = 2 molal
To Find: Mole fraction =?,
Solution:

Previous Topic: Numerical Problems on Molality
Next Topic: Solutions of Gases in Liquids
Dodaj komentarz