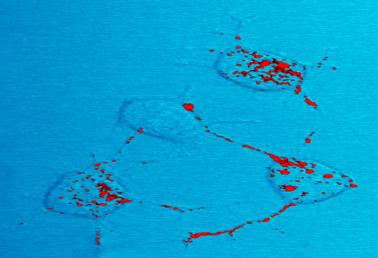
Prionprotein, rot dargestellt, kann ansteckend werden und neurodegenerative Erkrankungen verursachen. Hier veranschaulichen vier Nervenzellen in einer Maus, wie sich infektiöses Prionprotein innerhalb von Zellen entlang Neuriten bewegt-drahtartige Verbindungen, die Nervenzellen für die Kommunikation mit benachbarten Zellen verwenden.,
Prionprotein, rot dargestellt, kann ansteckend werden und neurodegenerative Erkrankungen verursachen. Hier veranschaulichen vier Nervenzellen in einer Maus, wie sich infektiöses Prionprotein innerhalb von Zellen entlang Neuriten bewegt-drahtartige Verbindungen, die Nervenzellen für die Kommunikation mit benachbarten Zellen verwenden.
Prionenkrankheiten, auch als übertragbare spongiforme Enzephalopathien oder TSEs bekannt, sind eine Gruppe seltener, tödlicher Gehirnerkrankungen, die Tiere und Menschen betreffen., Sie werden durch ein infektiöses Agens verursacht, das als Prion bekannt ist, das von einer fehlgefalteten Version eines normalen Wirtsproteins abgeleitet ist, das als Prionenprotein bekannt ist. Prionenkrankheiten umfassen spongiforme Rinderenzephalopathie (BSE oder“ Rinderwahnsinn“) bei Rindern, Creutzfeldt-Jakob-Krankheit (CJD) und Variante CJD beim Menschen, Scrapie bei Schafen und chronische Verschwendungskrankheit (CWD) bei Hirschen, Elchen, Elchen und Rentieren.
Warum hat die Untersuchung von Prionenkrankheiten für NIAID Priorität?,
Prionenkrankheiten sind ein bedeutendes Problem der öffentlichen Gesundheit und verbreiten sich bekanntermaßen von Tieren auf Menschen und im Falle der Variante Creutzfeldt-Jakob-Krankheit von Mensch zu Mensch durch Blut. Prionenkrankheiten bei Menschen sind schwer zu diagnostizieren, und wenn sie diagnostiziert werden, stehen keine wirksamen Behandlungen zur Verfügung. Infolgedessen sind sie unvermeidlich tödlich. Vieles über Prionenkrankheiten bleibt jedoch unbekannt, und das Verständnis ihrer Funktionsweise ist wichtig für die Entwicklung sowohl diagnostischer Tests als auch wirksamer Therapien., Prionenkrankheiten stehen auch im Zusammenhang mit anderen Proteinfehlfaltungskrankheiten wie Alzheimer, Parkinson und Lewy-Körperdemenz. Prionenkrankheiten stehen auch im Zusammenhang mit Erkrankungen, bei denen das Tau-Protein fehlgefaltet wird, einschließlich der chronischen traumatischen Enzephalopathie (CTE), die mit Hirnschäden durch wiederholte Kopfverletzungen einhergeht. So kann die Erforschung von Prionenkrankheiten auch Wissenschaftlern helfen, andere verwandte Krankheiten besser zu verstehen.
Wie geht NIAID mit diesem kritischen Thema um?,
NIAID-Wissenschaftler untersuchen, wie sich Prionenkrankheiten zwischen Mensch und Tier entwickeln und verbreiten, wie sie diagnostiziert und wie sie behandelt werden können. NIAID betreibt Prionenkrankheitsforschung in seinen Rocky Mountain Laboratories in Hamilton, Montana, und finanziert auch Prionenkrankheitsforschung in Universitätslabors. NIAID-Kooperationen mit anderen NIH-Gruppen zur Untersuchung von Alterungsstörungen und neurologischen Erkrankungen sind ebenfalls wichtig., Zwei weitere Institute der National Institutes of Health finanzieren ebenfalls die Prion Disease Research—das National Institute of Neurological Disorders and Stroke und das National Institute on Aging.
Um mehr über Risikofaktoren für Prionenkrankheiten und aktuelle Präventions-und Behandlungsstrategien zu erfahren, besuchen Sie die Website der Prionenkrankheiten der Centers for Diseases Control and Prevention (CDC).,op-Test für ungewöhnliche Erkrankungen des Gehirns
Oktober 16, 2019
August 2, 2019
NIAID Now Blog
-
Tag der seltenen Krankheiten 2019-NIAID Ressourcen und Forschungshighlights Februar 2019
&Genetik
Prionenerkrankungen sind mit dem Prionenprotein assoziiert, das in vielen Körpergeweben, einschließlich des Gehirns, vorkommt., Normalerweise verursacht Prionprotein keine Krankheit und befindet sich auf der Oberfläche vieler Zelltypen. Obwohl untersucht, denken Wissenschaftler, dass normales Prionprotein helfen könnte, das Gehirn vor Schäden zu schützen. Sie wissen, dass, wenn viele normale Prionenproteinmoleküle ihre Form ändern und zusammenklumpen, sie sich im Gehirngewebe ansammeln und die infektiösen Prionen bilden können, die Prionenerkrankungen verursachen. Prionenkrankheiten werden daher durch ein infektiöses, abnormal geformtes und aggregiertes Prionsprotein verursacht. Wissenschaftler sind sich nicht sicher, warum normales Prionprotein falsch zugeschnitten wird., NIAID-Wissenschaftler haben das Prionenproteingen mitentdeckt und waren unter den ersten, die zeigten, dass abnormes Prionenprotein normales Prionenprotein in die abnormale, infektiöse Form verändern kann.
Lesen Sie mehr über Prionenkrankheiten Biologie und Genetik
Therapeutische Ansätze
Obwohl es keine bekannten Wege zur Heilung von Prionenkrankheiten gibt, arbeiten Wissenschaftler auf der ganzen Welt an der Entwicklung von Behandlungen und Diagnostik. NIAID-Forscher haben einen schnellen diagnostischen Test für Prionenkrankheiten entwickelt., Mithilfe von Reagenzglas – oder zellbasierten Modellen der Prioneninfektion für ein schnelles Erstscreening haben NIAID-Forscher auch Tausende von Verbindungen getestet und Hunderte von Molekülen identifiziert, die die Bildung der abnormalen, infektiösen Form von Prionenprotein hemmen. Weitere Tests des wirksamsten dieser Inhibitoren haben mehrere ergeben, die das Leben von Nagetieren verlängern können, selbst wenn die Behandlung nach der Infektion beginnt.,
Lesen Sie mehr über therapeutische Ansätze für Prionenkrankheiten
Tierische Prionenkrankheiten und Menschen
Es gibt 3 Hauptprionenkrankheiten bei Tieren: Scrapie bei Schafen, bovine spongiforme Enzephalopathie (BSE) bei Rindern und chronische Verschwendungskrankheit (CWD) bei Hirschen, Elchen und anderen Zerviden. NIAID-Wissenschaftler verwenden verschiedene experimentelle Modelle, um zu untersuchen, wie Prionen einer Tierart verschiedene Tierarten infizieren können. Dazu gehören Studien, um festzustellen, ob Tierkrankheiten wie CWD Menschen infizieren und die Creutzfeldt-Jakob-Krankheit (CJD) verursachen können.,
Lesen Sie mehr über tierische Prionenkrankheiten und Menschen
Schreibe einen Kommentar