Ciências > Química > Soluções e a Sua Colligative Propriedades de > corte Curto Métodos Para o Cálculo de Concentração das Soluções
neste artigo, estudaremos corte curto métodos para calcular molality, molarity, etc.
estes métodos só podem ser utilizados em exames competitivos.,
Direto Fórmulas para Calcular Molality e Molarity:

, Onde M = molarity em mol L-1 ou M
m = molality em mol kg-1 ou m
a = % por massa de soluto
d = densidade da solução em g/mL ou g cm-3.,
MB = massa Molecular do soluto, em gramas
MA = massa Molecular do solvente em gramas
Nota: Ao usar essas fórmulas, tome cuidado para que as quantidades estão prescritos unidades
massas Moleculares de certas substâncias em gramas:
Problemas Numéricos para Calcular Molality e Molarity:
Exemplo 01:
A densidade de uma solução contendo 13 % em massa de ácido sulfúrico é de 1,09 g/mL. Calcular molaridade e normalidade da solução
dado: a = 13, d =1, 09 g/mL
para encontrar: molaridade (M)=? e normalidade (N)=?,
Solução:
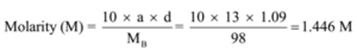
n = Molecular massa/massa equivalente = 98 g/49 g = 2
a Normalidade = molarity x n = 1.446 x 2 = 2.892 N
Exemplo 02:
A densidade da 2.03 M solução de ácido acético (massa molecular = 60) em água é 1.017 g/mL. Calcular a molalidade da solução
dado: M = 2, 03, MB = 60 g mol-1, d = 1, 017 g/mL
para encontrar: molalidade (m) = ?,
Solução:

molality = m = 1/0.4410 = 2.268 molal
Exemplo 03:
A densidade de 10,0% em massa de solução de KCl em água é de 1,06 g/mL. Calcular a molalidade, a molaridade e a fracção molar do KCl.
dado: a = 10, d = 1, 06 g/mL
para encontrar: molaridade (M) =?, molality (m)=?, fracção molar (XB)=?
Solução:

Ans: Molarity 1.,42 M, Molality = 1.491 m, Mole fraction = 0.0261
Example – 04:
0.8 M solution of H2SO4 has a density of 1.06 g/cm3. calculate molality and mole fraction
Given: M = 0.8 M, d = 1.06 g/cm3.
To Find: Molality (m) =?, mole fraction (XB) =?
Solution:

molality = m = 1/1.227 = 0.814 molal

0.814 x 18 x (1 – XB) = 1000 XB
14.,652 – 14.652 XB = 1000 XB
1014.652 XB = 14.652
XB = 14.652/1014.652 = 0.014
Exemplo – 05:
Um 6.90 M solução de KOH em água contém 30% em massa de KOH. Calcular a densidade da solução.
dado: M = 6,90 m, a = 30
para encontrar: densidade da solução = d = ?
Solução:

Ans: Densidade da solução = 1.288 g/mL
Exemplo – 06:
Dado: a = 10, d = 1.070 g cm-3,
Para Encontrar: mole fração =? molarity = ?, and molality =?
Solution:

Example – 07:
Calculate the mole fraction of solute in its 2 molal aqueous solution.
Given: molality = 2 molal
To Find: Mole fraction =?,
Solution:

Previous Topic: Numerical Problems on Molality
Next Topic: Solutions of Gases in Liquids
Deixe uma resposta