punctul de Înghețare Punct de Depresie
La punctul de solidificare al unei substanțe este temperatura la care cele solide și lichide forme pot coexista pe termen nelimitat — care este, ele sunt în echilibru. În aceste condiții moleculele trec între cele două faze la rate egale, deoarece tendințele lor de scăpare din cele două faze sunt identice., Să presupunem că un solvent lichid și solid (apă și gheață, de exemplu) sunt în echilibru (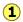 de mai jos), și vom adăuga un non-volatile dizolvate (cum ar fi sare, zahăr, sau antigel auto lichid) pentru apă. Acest lucru va avea ca efect reducerea fracției molare a moleculelor H2O în faza lichidă și, astfel, reducerea tendinței acestor molecule de a scăpa de ea, nu numai în faza de vapori (așa cum am văzut mai sus), ci și în faza solidă (gheață)., Acest lucru va avea nici un efect asupra ratei la care molecule H2O scăpa de gheață în faza de apă, astfel încât sistemul nu va mai fi în echilibru și gheața va începe să se topească
de mai jos), și vom adăuga un non-volatile dizolvate (cum ar fi sare, zahăr, sau antigel auto lichid) pentru apă. Acest lucru va avea ca efect reducerea fracției molare a moleculelor H2O în faza lichidă și, astfel, reducerea tendinței acestor molecule de a scăpa de ea, nu numai în faza de vapori (așa cum am văzut mai sus), ci și în faza solidă (gheață)., Acest lucru va avea nici un efect asupra ratei la care molecule H2O scăpa de gheață în faza de apă, astfel încât sistemul nu va mai fi în echilibru și gheața va începe să se topească .
.

Dacă dorim să ținem solid de topire, evadarea tendința de moleculele de solid trebuie să fie redusă., Acest lucru poate fi realizat prin reducerea temperaturii; acest lucru reduce tendința de a scăpa de molecule din ambele faze, dar îi afectează pe cei din solid mai mult decât cele în stare lichidă, așa că în cele din urmă ajunge la noi, mai mici de congelare punctul unde cele două cantități sunt din nou în echilibru exact și ambele faze pot coexista  .dacă preferați să gândiți în ceea ce privește presiunile de vapori, puteți utiliza același argument dacă rețineți că presiunile de vapori ale solidului și lichidului trebuie să fie aceleași la punctul de îngheț., Diluare lichid (solvent) de nevolatila solut reduce presiunea de vapori a solventului potrivit lui Raoult legea lui, reducând astfel temperatura la care presiunile de vapori de lichid și congelate forme de soluție va fi egal. Ca și în cazul elevării punctului de fierbere, în soluțiile diluate există o relație liniară simplă între depresiunea punctului de îngheț și molalitatea solutului:
.dacă preferați să gândiți în ceea ce privește presiunile de vapori, puteți utiliza același argument dacă rețineți că presiunile de vapori ale solidului și lichidului trebuie să fie aceleași la punctul de îngheț., Diluare lichid (solvent) de nevolatila solut reduce presiunea de vapori a solventului potrivit lui Raoult legea lui, reducând astfel temperatura la care presiunile de vapori de lichid și congelate forme de soluție va fi egal. Ca și în cazul elevării punctului de fierbere, în soluțiile diluate există o relație liniară simplă între depresiunea punctului de îngheț și molalitatea solutului:
\
rețineți că valorile Kf sunt toate negative!
drumuri de sărare
utilizarea sării pentru drumurile de gheață este o aplicație comună a acestui principiu., Soluția formată atunci când o parte din sare se dizolvă în gheața umedă reduce punctul de îngheț al gheții. Dacă punctul de îngheț scade sub temperatura ambiantă, gheața se topește. În vreme foarte rece, temperatura ambiantă poate fi sub cea a soluției de sare, iar sarea nu va avea niciun efect.,d=”3d8b2121c5″>
CaCl2
Automotive radiator antifreezes are mostly based on ethylene glycol, (CH2OH)2., Datorită proprietăților puternice de legare a hidrogenului acestui alcool dublu, această substanță este miscibilă cu apă în toate proporțiile și contribuie doar la o presiune de vapori foarte mică. Pe lângă scăderea punctului de îngheț, antigelul ridică și punctul de fierbere, mărind domeniul de funcționare al sistemului de răcire. Glicolul pur îngheață la -12,9°C și fierbe la 197°c, permițând amestecurilor de apă-glicol să fie adaptate la o gamă largă de condiții.,
exemplu \(\PageIndex{2}\)
estimarea punctului de îngheț al unui amestec antigel se compune prin combinarea unui volum de etilenglicol (MW = 62, densitate 1,11 g cm–3) cu două volume de apă.presupunem că folosim 1 L de glicol și 2 l de apă (volumele reale nu contează atât timp cât rapoartele lor sunt date.) Masa glicolului va fi de 1,10 kg, iar cea a apei va fi de 2,0 kg, deci masa totală a soluției este de 3,11 kg. Avem apoi:
- numărul de moli de glicol: (1110 g) ÷ (62 g mol–1) = 17.,9 mol
- molalitatea de glicol: (17.9 mol) ÷ (2.00 kg) = 8.95 mol kg–1
- punctul de înghețare punct de depresie: ΔTF = (-1.86 K kg–1 mol) × (8.95 mol kg–1) = -16.6 K astfel încât soluția va îngheța la -17°C.
Orice speciilor ionice formate prin disociere va contribui, de asemenea, la punctul de înghețare punct de depresie. Acest lucru poate servi ca un mijloc util de determinare a fracției unui solut care este disociat.
Lasă un răspuns