Știința > Chimie > Soluții și Lor Colligative Proprietăți > Short-cut Metode Pentru Calculul Concentrației de Soluții
În acest articol, vom studia scurt-cut metode pentru a calcula molalitate, molaritate, etc.
aceste metode pot fi utilizate numai în examenele competitive.,
Direct de Formule pentru a Calcula Molalitatea și Molaritate:

în cazul în Care M = molaritatea în mol L-1 sau M
m = molalitatea în mol kg-1 sau m
o = % prin masa de substanță dizolvată
d = densitatea soluției în g/mL sau g cm-3.,Notă: Când utilizați aceste formule, aveți grijă ca cantitățile să fie în unități prescrise
masele moleculare ale anumitor substanțe în grame:
probleme numerice pentru a calcula Molalitatea și Molaritatea:
exemplu – 01: densitatea unei soluții care conține acid sulfuric 13% din masă este de 1,09 g/ml. Calculați molaritatea și normalitatea soluției
dat: a = 13, d = 1,09 g/mL
pentru a găsi: molaritate (M) =? și normalitatea (N) =?,
Soluție:
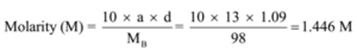
n = masa Moleculară/masă echivalentă = 98 g/49 g = 2
Normalitate = molaritate x n = 1.446 x 2 = 2.892 N
Exemplu – 02:
densitatea de 2,03 M, soluție de acid acetic (masa moleculară = 60) în apă este de 1.017 g/mL. Calculați molalitatea soluției
dat: M = 2,03, MB = 60 g mol-1, d = 1,017 g/mL
pentru a găsi: molalitate (m) = ?,
Rezolvare:

molalitatea = m = 1/0.4410 = 2.268 molal
Exemplu – 03:
densitatea de 10,0% din masa de soluție KCl în apă este de 1,06 g/mL. Calculați molalitatea, molaritatea și fracția molară a KCl.
dat: a = 10, d = 1,06 g/mL
pentru a găsi: molaritate (M) =?, molalitate (m) =?, fracțiune mol (XB) =?
Rezolvare:

Ans: Molaritate 1.,42 M, Molality = 1.491 m, Mole fraction = 0.0261
Example – 04:
0.8 M solution of H2SO4 has a density of 1.06 g/cm3. calculate molality and mole fraction
Given: M = 0.8 M, d = 1.06 g/cm3.
To Find: Molality (m) =?, mole fraction (XB) =?
Solution:

molality = m = 1/1.227 = 0.814 molal

0.814 x 18 x (1 – XB) = 1000 XB
14.,652 – 14.652 XB = 1000 XB
1014.652 XB = 14.652
XB = 14.652/1014.652 = 0.014
Exemplu – 05:
Un 6.90 M soluție de KOH în apă conține 30% din masa de KOH. Calculați densitatea soluției.
dat: M = 6,90 m, a = 30
pentru a găsi: densitatea soluției = d=?
Rezolvare:

Ans: Densitatea de soluție = 1.288 g/mL
Exemplu – 06:
Având în vedere: a = 10, d = de 1,070 g cm-3,
Pentru a Găsi: fracția molară =? molaritate = ?, and molality =?
Solution:

Example – 07:
Calculate the mole fraction of solute in its 2 molal aqueous solution.
Given: molality = 2 molal
To Find: Mole fraction =?,
Solution:

Previous Topic: Numerical Problems on Molality
Next Topic: Solutions of Gases in Liquids
Lasă un răspuns