vetenskap > Kemi > lösningar och deras kolligativa egenskaper > Short-cut metoder för beräkning av koncentration av lösningar
i den här artikeln ska vi studera korta metoder för att beräkna molalitet, molaritet etc.
dessa metoder kan endast användas i konkurrenskraftiga tentor.,
direkta formler för att beräkna molalitet och molaritet:

där M = molaritet i mol L-1 eller m
m = molalitet i mol kg-1 eller m
a = mol % av lösningens massa
D = lösningens densitet i g / ml eller g cm-3.,
MB = lösningens molekylmassa i gram
MA = lösningsmedlets molekylmassa i gram
Obs: vid användning av dessa formler, se till att kvantiteterna är i föreskrivna enheter
molekylmassor av vissa ämnen i gram:
numeriska problem för att beräkna molalitet och molaritet:
exempel – 01:
densiteten hos en lösning innehållande 13 viktprocent svavelsyra är 1, 09 g / ml. Beräkna molaritet och normalitet av lösningen
givet: a= 13, d = 1,09 g / mL
För att hitta: molaritet (m)=? och normalitet (N) =?,
lösning:
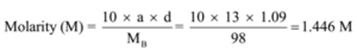
n = Molekylvikt/motsvarande massa = 98 g/49 g = 2
normalitet = molaritet x n = 1.446 x 2 = 2.892 n
exempel – 02:
tätheten av 2,03 m lösning av ättiksyra (molekylvikt = 60) i vatten är 1,017 g / ml. Beräkna molalitet av lösningen
givet: m = 2,03, MB = 60 g mol-1, d = 1,017 g/mL
För att hitta: molalitet (m) = ?,
lösning:

molalitet = m = 1/0.4410 = 2.268 molal
exempel – 03:
tätheten av 10,0 viktprocent KCl-lösning i vatten är 1,06 g/ml. Beräkna molalitet, molaritet och molfraktion av KCl.
givet: a = 10, d =1,06 g/mL
För att hitta: molaritet (m)=?, molalitet (m)=?, mullvad fraktion (XB) =?
lösning:

Ans: molaritet 1.,42 M, Molality = 1.491 m, Mole fraction = 0.0261
Example – 04:
0.8 M solution of H2SO4 has a density of 1.06 g/cm3. calculate molality and mole fraction
Given: M = 0.8 M, d = 1.06 g/cm3.
To Find: Molality (m) =?, mole fraction (XB) =?
Solution:

molality = m = 1/1.227 = 0.814 molal

0.814 x 18 x (1 – XB) = 1000 XB
14.,652-14.652 XB = 1000 XB
1014.652 XB = 14.652
XB = 14.652 / 1014.652 = 0.014
exempel-05:
en 6,90 M lösning av KOH i vatten innehåller 30% av massan av KOH. Beräkna tätheten av lösningen.
givet: m = 6,90 m, a = 30
För att hitta: densitet av lösning = d=?
lösning:

Ans: density of solution = 1.288 g/mL
exempel – 06:
given: a = 10, d = 1.070 g cm-3,
för att hitta: Mole fraction =? molaritet = ?, and molality =?
Solution:

Example – 07:
Calculate the mole fraction of solute in its 2 molal aqueous solution.
Given: molality = 2 molal
To Find: Mole fraction =?,
Solution:

Previous Topic: Numerical Problems on Molality
Next Topic: Solutions of Gases in Liquids
Lämna ett svar