Nicht lange nachdem G. N. Lewis das Elektron-Punkt-Modell populär machte, wurde die Quantenmechanik zu einem sehr starken Modell, einschließlich seiner Verwendung zur Beschreibung der chemischen Bindung. Zwei Modelle-das Valenzbindungsmodell und das molekulare Orbitalmodell-wurden fast gleichzeitig entwickelt. Linus Pauling wurde der Champion des Valence Bond-Modells, das einfacher zu visualisieren und zu verwenden ist. Dieses Modell ist im Wesentlichen eine quantenmechanische Version des Elektron-Punkt-Modells: Es versucht zu beschreiben, welche Orbitale von jedem Atom verwendet werden, wenn Elektronen geteilt werden., Wenn beispielsweise das einfache Molekül H2 aus Wasserstoffatomen gebildet wird, besagt das Valenzbindungsmodell, dass sich ein s-Orbital auf einem Atom mit einem s-Orbital auf dem anderen überlappt, um eine Bindung zu bilden. Dies wird manchmal durch ein Überlappungsdiagramm und ein Bild dargestellt, wie in Abbildung 30 gezeigt.

Abbildung 30. Überlappungsdiagramm und Bild für die Valenzbindungsbeschreibung von zweiatomigem Wasserstoff.,
Eines der Probleme, auf das Pauling schon früh in seinen Pionierbemühungen mit der Valenzbindungstheorie gestoßen ist, wird deutlich durch ein einfaches Valenzbindebild der Bindung im Wasser veranschaulicht. Abbildung 31 zeigt zwei p-Orbitale auf Sauerstoff, die sich mit s-Orbitalen auf Hydrogenen überlappen. Dieses Bild zeigt deutlich, dass der Bindungswinkel in Wasser 90° betragen sollte, da die beiden p-Orbitale entlang der x – und y-Achse ausgerichtet sind und daher senkrecht stehen.

Abbildung 31. Orbitalüberlappung im Wasser.,
Tatsächlich beträgt der Bindungswinkel in Wasser 105°, eine signifikante Abweichung von 90°. Diese Art von Fehler scheint Ihnen vielleicht nicht signifikant zu sein, aber für jemanden, der versucht, ein Modell zu formulieren, das so viel von einem bestimmten Teil der Natur wie möglich erklärt, ist dieser Unterschied zwischen Theorie und experimenteller Tatsache sehr störend. Pauling fügte dann eine weitere Modifikation der Theorie hinzu-Hybridisierung., Pauling sagte, dass Atomorbitale auf einem Atom nicht sakrosankt sind, sondern nur eine mögliche Menge mathematischer Gleichungen (denken Sie an unsere Diskussion über das Wellenmodell), mit denen die Elektronen in diesem Atom beschrieben werden können. Andere Mengen können erzeugt werden, indem diese Atomorbitale nach bestimmten Regeln addiert und subtrahiert werden. Wenn also ein s-Orbital und die drei p-Orbitale mathematisch kombiniert werden, wird ein neuer Satz von Orbitalen, sp3-Orbitale, erzeugt. Der neue Satz von Orbitalen hat andere Orientierungsmerkmale als der Satz von Atomorbitalen., Abbildung 32 zeigt die s-und drei p-Orbitale in Teil (a) und dann in Teil (b) die vier neuen sp3-Hybriden. Wie Sie sehen, sind diese sp3-Hybriden auf die Ecken eines Tetraeders ausgerichtet. Abbildung 33 zeigt, dass diese Hybriden zur Beschreibung der Bindung in Wasser verwendet werden. Da der Winkel zwischen den Hybriden 109° beträgt, erwarten wir nun, dass der Bindungswinkel in Wasser 109°beträgt. Dies gibt uns eindeutig eine bessere Übereinstimmung mit dem experimentellen Wert von 105°. (Beachten Sie, dass dies nicht in perfekter Übereinstimmung ist, aber es ist das Beste, was wir tun können.,) Andere Hybridisierungskombinationen sind ebenfalls möglich, und diese sind in Abbildung 34 zusammengefasst.

Abbildung 32. sp3-Hybridisierung.
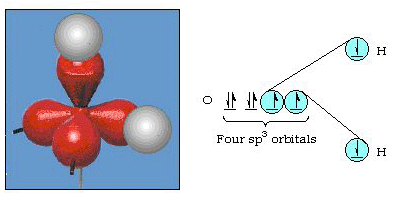
Abbildung 33. Verwendung von sp3-Hybriden zur Erklärung des Bindungswinkels im Wasser.
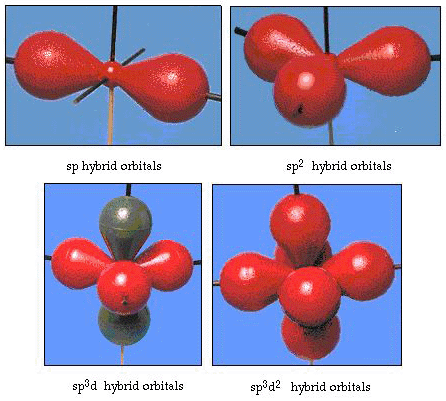
Abbildung 34). Andere hybridisierungs-Schemata.
Presse für Video
Es gibt eine andere Funktion des Valence Bond-Modell, das Diskussion verdient. Es ist schön illustriert durch unser bekanntes Sauerstoffmolekül O2., Abbildung 35 zeigt die Überlappung zweier px-Orbitale, um uns eine einzige Bindung zu geben. Wenn wir der Oktettregel gehorchen wollen, müssen wir auch eine andere Bindung eingehen. Dies muss durch Überlappung von zwei py-oder zwei pz-Orbitalen erfolgen (es spielt keine Rolle, welche). Diese Bindung hat ihre Elektronendichte über und unter der internuklearen Linie und nicht direkt zwischen den beiden Sauerstoffkernen. Diese Bindung wird als 1-Bindung bezeichnet, während diejenige, die die Elektronendichte zwischen die Atome setzt, als Sigma (σ) – Bindung bezeichnet wird., Eine der interessanten Folgen dieses Bildes ist, dass erwartet wird, dass die 1-Bindung schwächer als die Sigma-Bindung ist (die Überlappung der Orbitale ist schwächer). Dies bedeutet, dass eine Doppelbindung nicht die Stärke von zwei Einzelbindungen aufweist und auch anfälliger für Angriffe durch externe Atome ist, die nach Elektronendichte suchen.

Abbildung 35. Bildung von Sigma – und Pi-Bindungen in zweiatomigem Sauerstoff.,
Als letztes Beispiel für die Valenzbindungsbehandlung der Bindung zeigt Abbildung 36 ein Bild der an der Bindung beteiligten Orbitale in Ethen, dem einfachsten ungesättigten Kohlenwasserstoff (H2C=CH2). Experimentell wurde gezeigt, dass die Bindungswinkel um jeden Kohlenstoff fast 120°betragen. So zeigt unser Bild die Verwendung von sp2-Hybriden (weil sie 120° Winkel zueinander haben) für den Aufbau der Sigma-Bindungen. Die 1-Bindung wird durch Überlappung zweier pz-Orbitale gebildet. Es ist wichtig zu beachten, dass die 1-Bindung eine Rotationsbarriere über die Kohlenstoff-Kohlenstoff-Verknüpfung einführt., Das heißt, wenn sich eine CH2-Gruppe drehen würde, müsste die 1-Bindung gebrochen werden, was erhebliche Energie erfordern würde. Die Folge davon ist, dass die 1-Bindung die beiden CH2-Gruppen in einer Ebene fixiert, wodurch das Gesamtmolekül planar ist.

Abbildung 36. Die Bindung in ethen.
Das molekulare Orbitalmodell verfolgt einen anderen Ansatz. Es nutzt alle Orbitale auf allen Atomen, um eine Reihe von Orbitalen zu erzeugen, die sich über alle Atome des gesamten Moleküls erstrecken., Das molekulare Orbitalmodell ist schwieriger zu visualisieren, aber es ist auch leistungsfähiger. Der schwierige Prozess der Bestimmung, wie atomare Orbitale kombiniert werden können, um molekulare Orbitale zu erzeugen, wird jetzt auch für große Moleküle per Computer durchgeführt. Der praktizierende Chemiker verwendet das molekulare Orbitalmodell, um Spektren, Übergangszustände usw. vorherzusagen., aber für alltägliche chemische Diskussionen, Die Elektron-Punkt-und Valenzbindungsmodelle regieren immer noch den Tag.
Schreibe einen Kommentar